
一、 circTFDP2在PCa中高表达
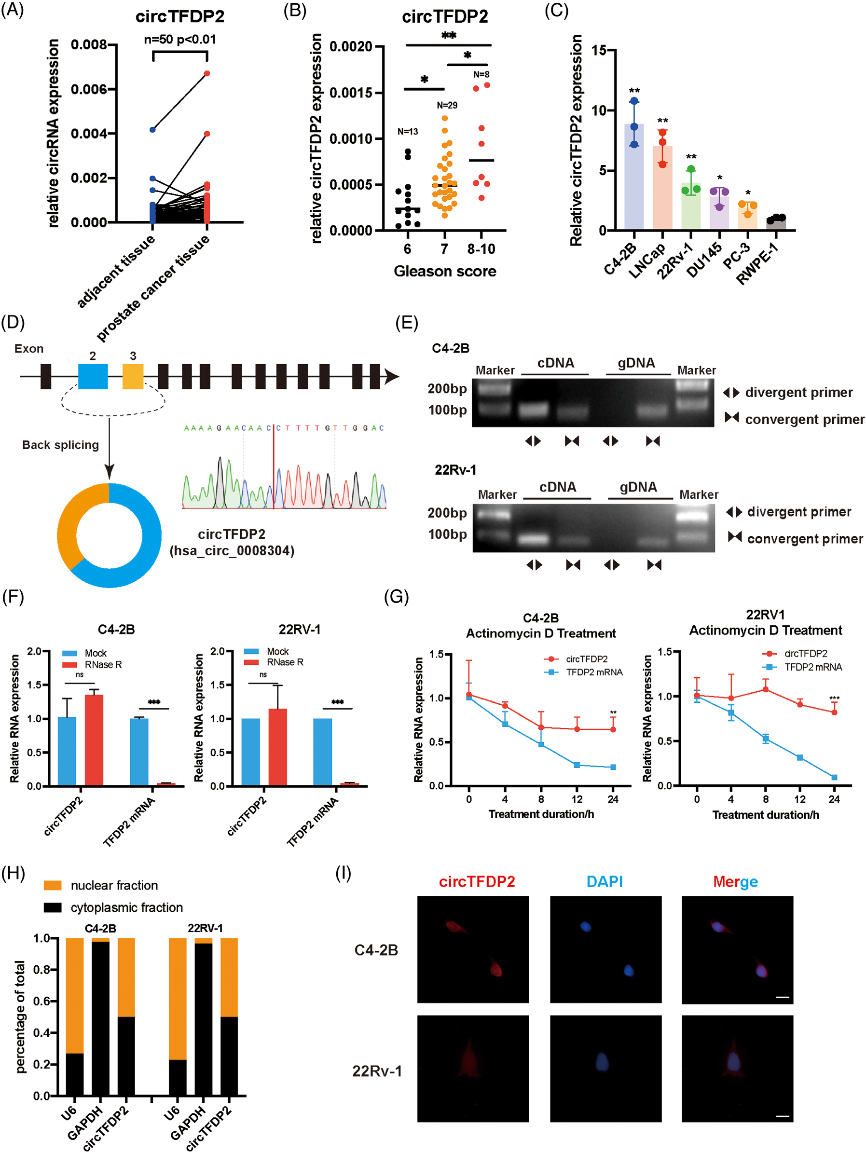
图1. circTFDP2的筛选过程及特性
二、 eIF4A3在PCa中调控circTFDP2的生物发生
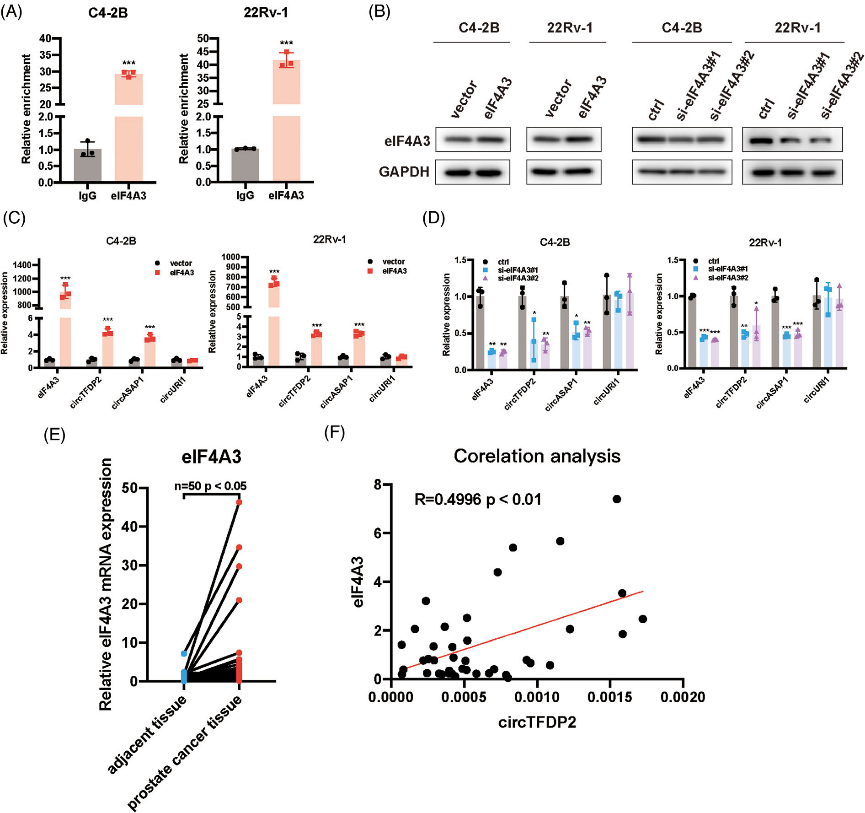
图2. eIF4A3在PCa中调控circTFDP2的生物发生
三、circTFDP2促进PCa细胞增殖,抑制其凋亡并促进PCa细胞迁移
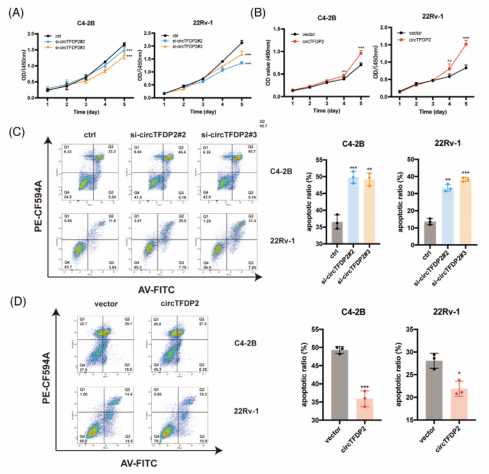
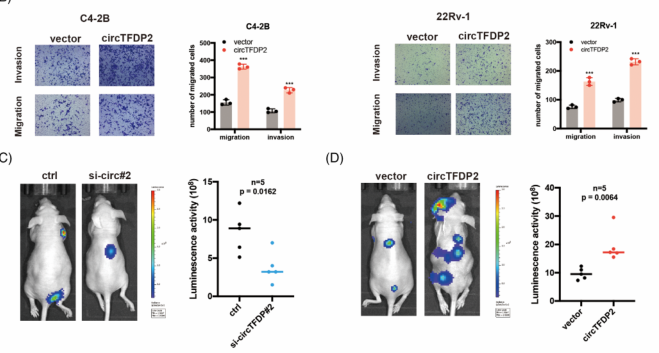
图3. circTFDP2促进PCa细胞增殖,抑制其凋亡并促进PCa细胞转移
四、 circTFDP2与PARP1相互作用并阻止其裂解
接下来,作者设计circTFDP2探针进行pulldown实验,发现有26个蛋白与circTFDP2特异性相互作用。在这些RBP中,PARP1由于可以抵抗前列腺癌症,被选为潜在的下游。PARP1-RIP实验证实了PARP1与circTFDP2之间的相互作用。FISH和IF检测确定了PARP1和circTFDP2之间的共定位。这些数据表明circTFDP2和PARP1在PCa细胞中形成了RNA蛋白复合物。
基于PARP1和circTFDP2之间的相互作用,作者研究了PARP1是否影响circTFDP2的表达。结果显示,circTFDP2的过表达或敲低都不能改变PARP1的表达和定位,这表明circTFDP2在转录后水平上没有调节PARP1的表达。
但是,由于circTFDP2与PARP1结合,而PARP1的DNA结合区被活跃的caspase-3识别并切割,作者假设circTFDP2影响这一过程。
WB实验显示,过表达circTFDP2会降低裂解PARP1的表达,而敲低circTFDP2则会增加裂解PARP1的表达;circTFDP2敲低的PCa细胞中增强的PARP1裂解被caspase-3抑制剂Z-DEVD-FMK阻断,表明circTFDP2阻止了PARP1依赖caspase-3的活性裂解。上述数据表明circTFDP2可以减弱PARP1的裂解。
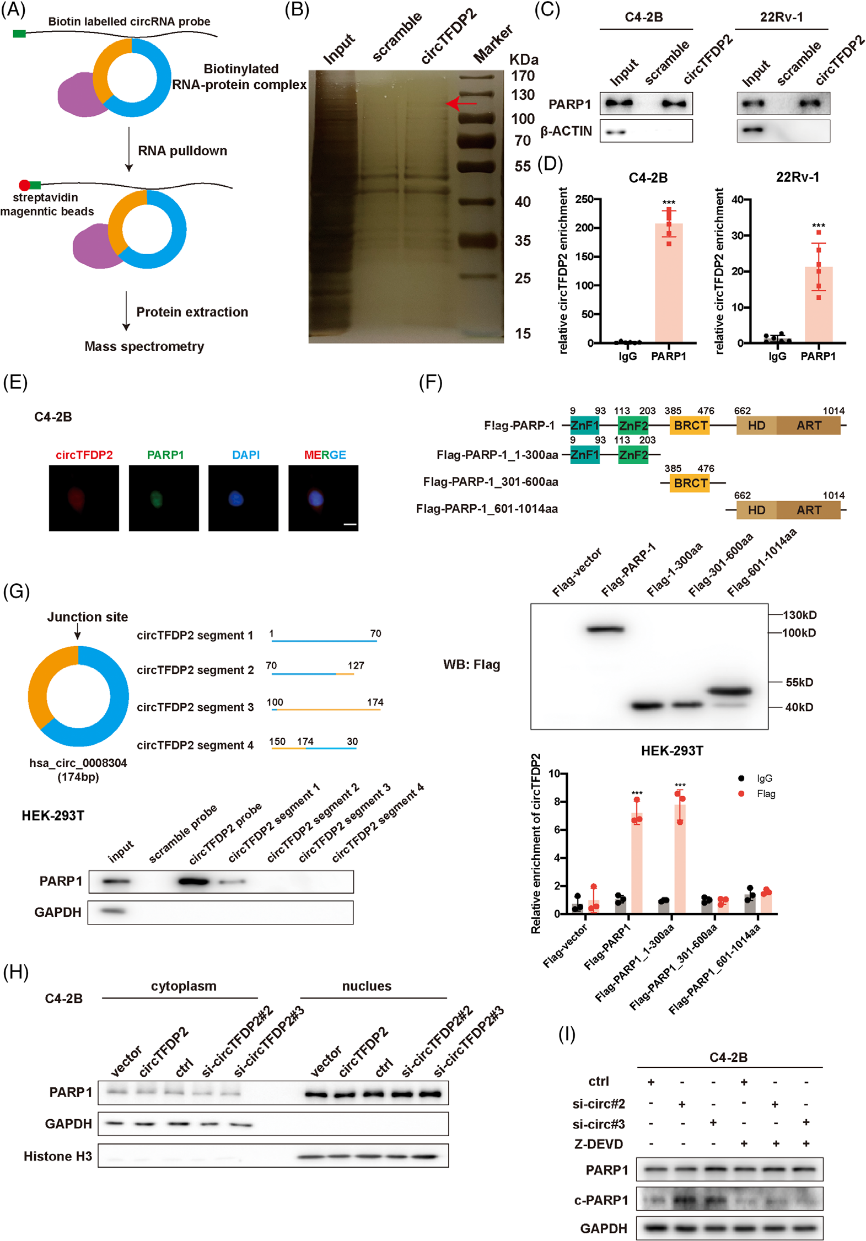
图4. circTFDP2与PARP1相互作用并阻止其裂解
五、 PARP1促进前列腺癌细胞增殖和迁移
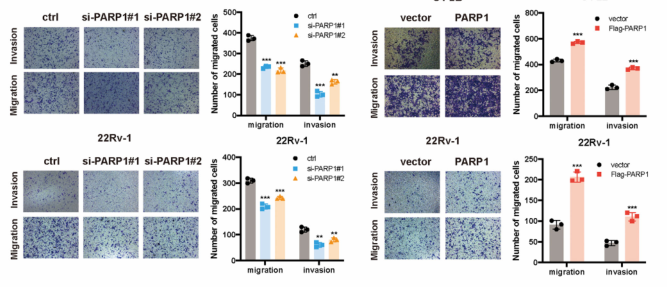
图5. PARP1促进前列腺癌细胞增殖和迁移
六、circTFDP2通过PARP1调节前列腺癌细胞的DNA损伤
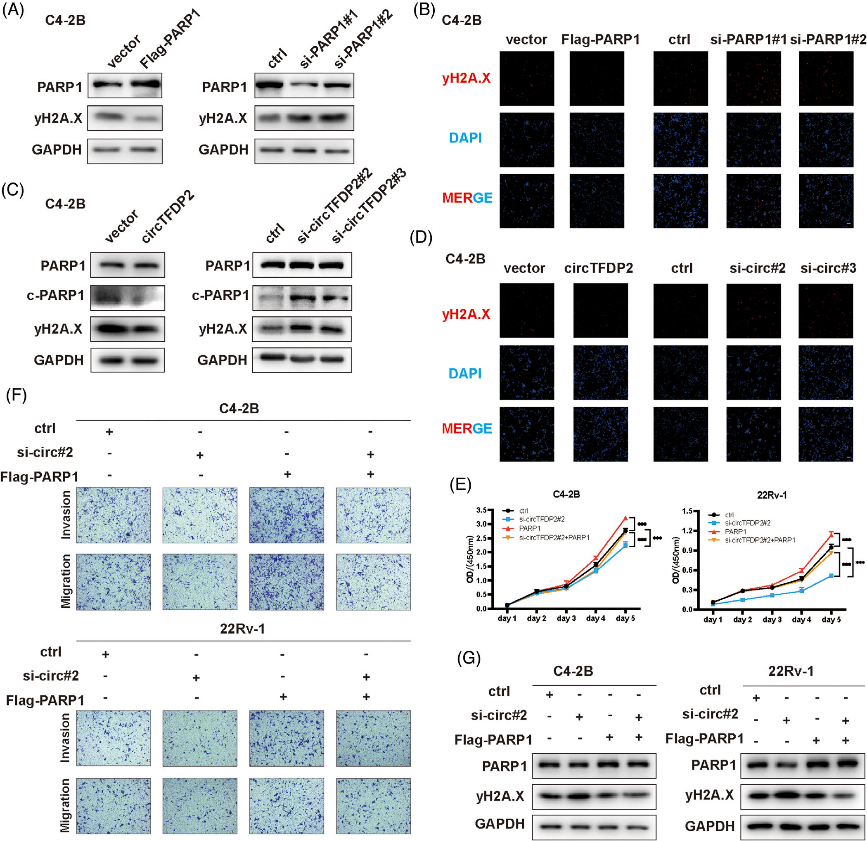
图6. circTFDP2通过PARP1调节前列腺癌细胞的DNA损伤
七、 外泌体递送的circTFDP2促进前列腺癌进展
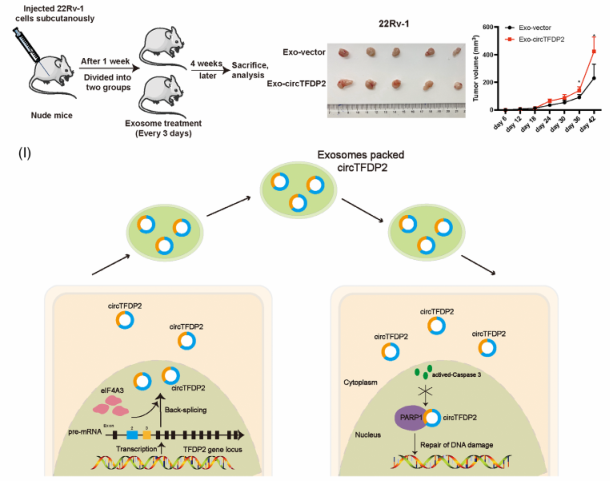
图7. 外泌体递送的circTFDP2促进前列腺癌进展
原文链接
https://doi.org/10.1002/ctm2.1156
参考文献
[1] Vlachaki A, Baltogiannis D, Batistatou A, et al. Screening for prostate cancer: moving forward in the molecular era. J BUON.2018;23:1242-1248.
[2] Singh S, Shyamal S, Panda AC. Detecting RNA–RNA interactome. Wiley Interdiscip Rev RNA. 2022;13:e1715.
.png)