环状RNA(circRNAs)是一类新的非编码RNA,由于具有高稳定性等特殊的分子特性,导致其在多种疾病尤其是在癌症的进展中发挥着重要作用[2]。然而,它们在NPC发生和转移中的作用和潜在机制仍不完全清楚。研究发现源自PVT1基因的circPVT1在NPC中高丰度,circPVT1可能是是鼻咽癌转移过程的关键调节因子,可能作为鼻咽癌诊断和治疗的新生物标志物或靶点。探究circRNA在NPC中的调节机制能够为广大NPC患者的早期诊断和治疗预后提供新思路。

1. 鼻咽癌中circPVT1的高表达与预后不良相关
作者结合两组RNA测序数据分析得出circPVT1在NPC中显著高表达,qRT-PCR和Sanger测序实验证实circPVT1来自8号染色体的一个lncRNA基因PVT1通过反向剪接形成。核质分离试验和荧光原位杂交证实circPVT1主要分布在细胞质,作者利用qRT-PCR实验发现circPVT1在NPC组织中高表达,原位杂交也证实了这一发现。另外,circPVT1的高表达与鼻咽癌患者的不良预后、临床分期、N分期和远处转移呈正相关。这些数据表明,circPVT1在鼻咽癌组织中有较高的表达并参与了鼻咽癌的发生发展过程。
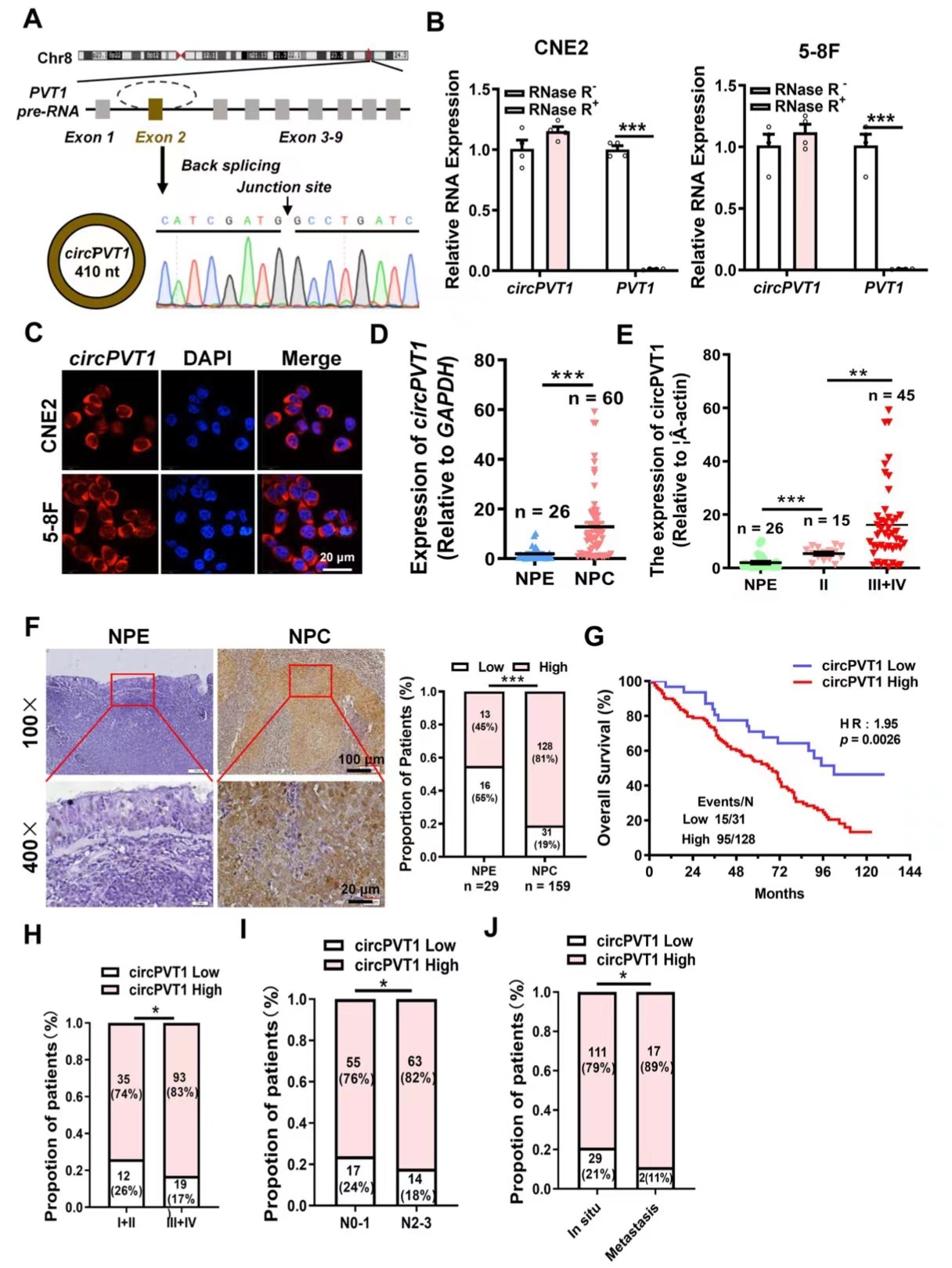 图1. circPVT1在鼻咽癌中高表达并导致预后不良
图1. circPVT1在鼻咽癌中高表达并导致预后不良
2. circPVT1促进鼻咽癌细胞在体内外的侵袭和转移
作者利用过表达/敲低实验、划痕实验、Transwell实验来探究circPVT1对NPC细胞侵袭和转移的影响。结果显示过表达circPVT1后,NPC细胞的迁移和侵袭能力显著增强,而对NPC的细胞生长和增殖没有影响。作者建立过表达或低表达的肺转移模型,发现circPVT1过表达组的肺结节数量显著高于对照组。然后,作者通过裸鼠腹股沟淋巴结转移模型、发现circPVT1组的腹股沟淋巴结大于对照组,IHC实验表明circPVT1组淋巴结中泛细胞角蛋白阳性表达显著高于circPVT2敲除组。这些结果表明,circPVT1在体外和体内均可促进鼻咽癌的侵袭和转移。
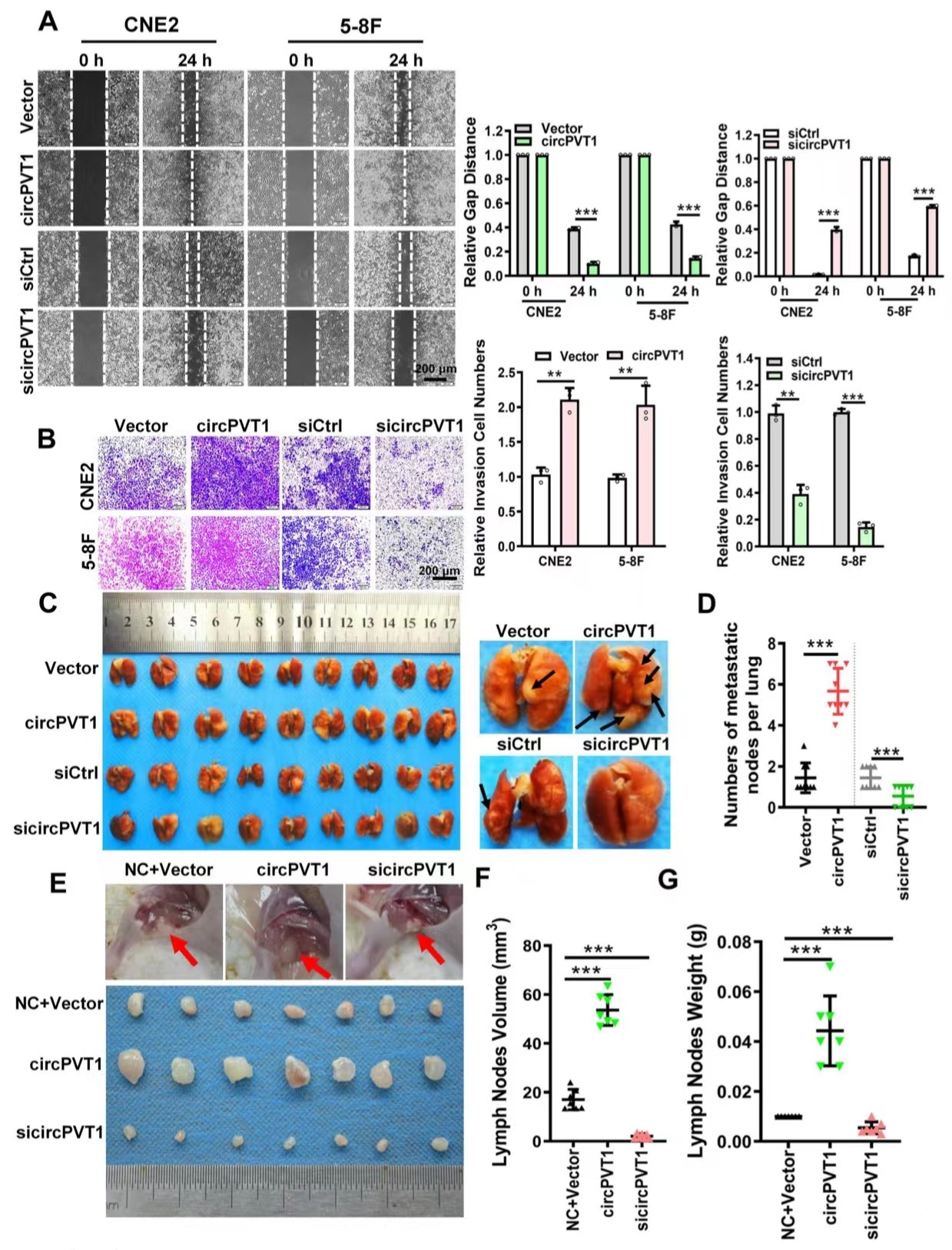
图2.circPVT1促进鼻咽癌细胞的迁移和侵袭
3. circPVT1通过结合β-TrCP促进鼻咽癌细胞的迁移和侵袭
作者为了探究circPVT1在鼻咽癌转移过程中的作用机制,利用生物素标记的circPVT1探针下调circPVT1鉴别了PVT1周围的结合蛋白,并利用RNA下拉实验、RIP实验、数据库预测等方法发现并证实了β-TrCP与circPVT1中230-280nt的片段结合作用。作者利用RNA下拉和RIP实验经过对照实验,发现circPVT1与β-TrCP的结合位点为β-TrCP的WD40结构域。划痕实验和Transwell实验进一步表明,过表达β-TrCP可以抑制NPC细胞的迁移和侵袭。综上所述,circPVT1与β-TrCP的WD40结构域相互作用,从而促进鼻咽癌细胞的迁移和侵袭。
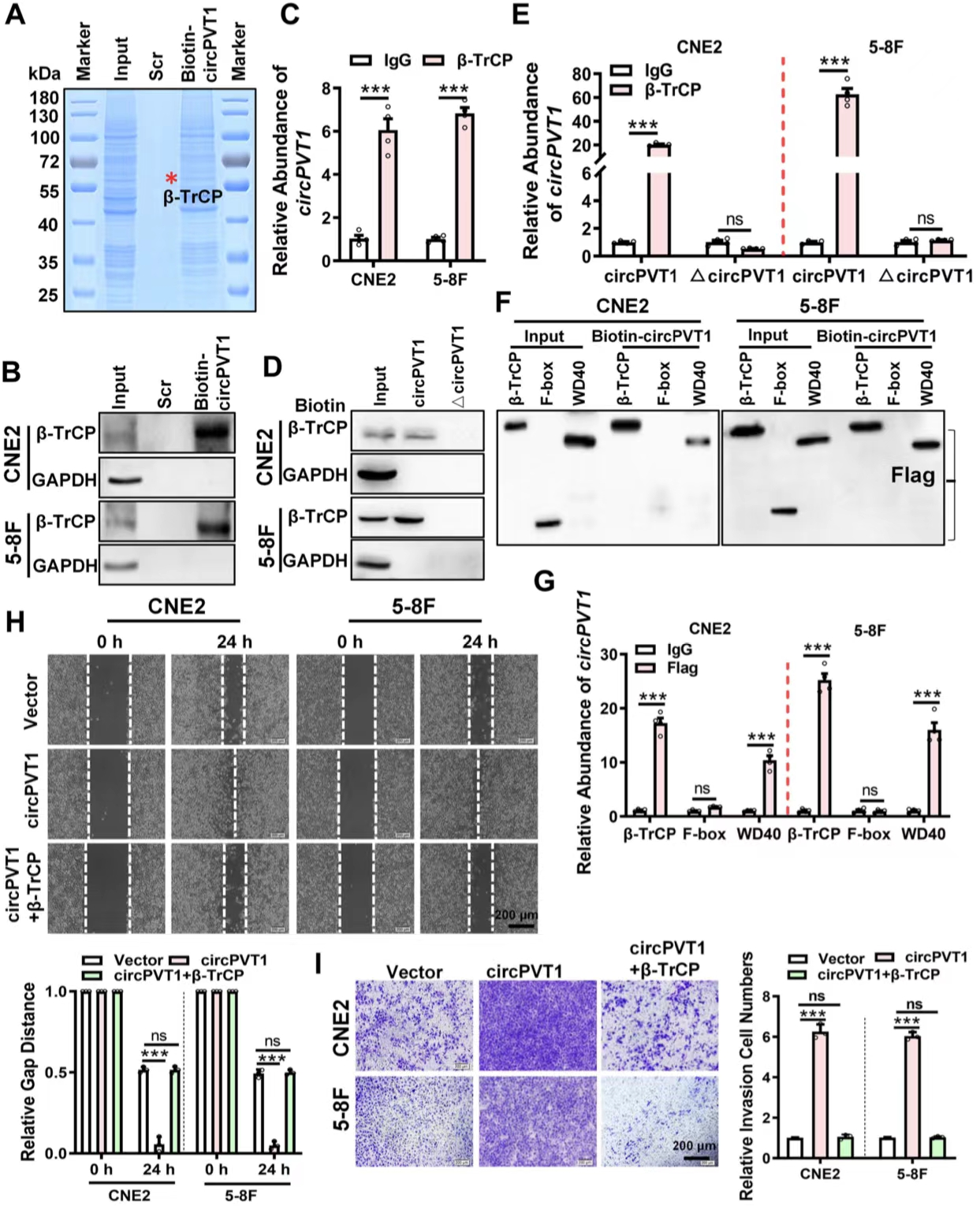
图3. circPVT1通过与β-TrCP结合促进鼻咽癌细胞的迁移和侵袭
4. c-Myc与β-TrCP结合并充当其泛素化底物
作者过表达或敲低circPVT1后发现circPVT1不影响β-TrCP的表达,所以推测circPVT1可能通过影响β-TrCP与其底物的结合来调节其下游蛋白的表达。作者运用Co-IP实验、质谱分析等技术鉴定了260种蛋白,发现c-Myc对β-TrCP表现出高亲和力。经过一系列的Co-IP证实了β-TrCP的WD40结构域与c-Myc之间的结合。作者还发现β-TrCP的过度表达增强了鼻咽癌细胞中c-Myc的泛素化,并降低了c-Myc蛋白水平。划痕实验和Transwell试验表明,β-TrCP的过度表达抑制了NPC细胞的迁移和侵袭性。
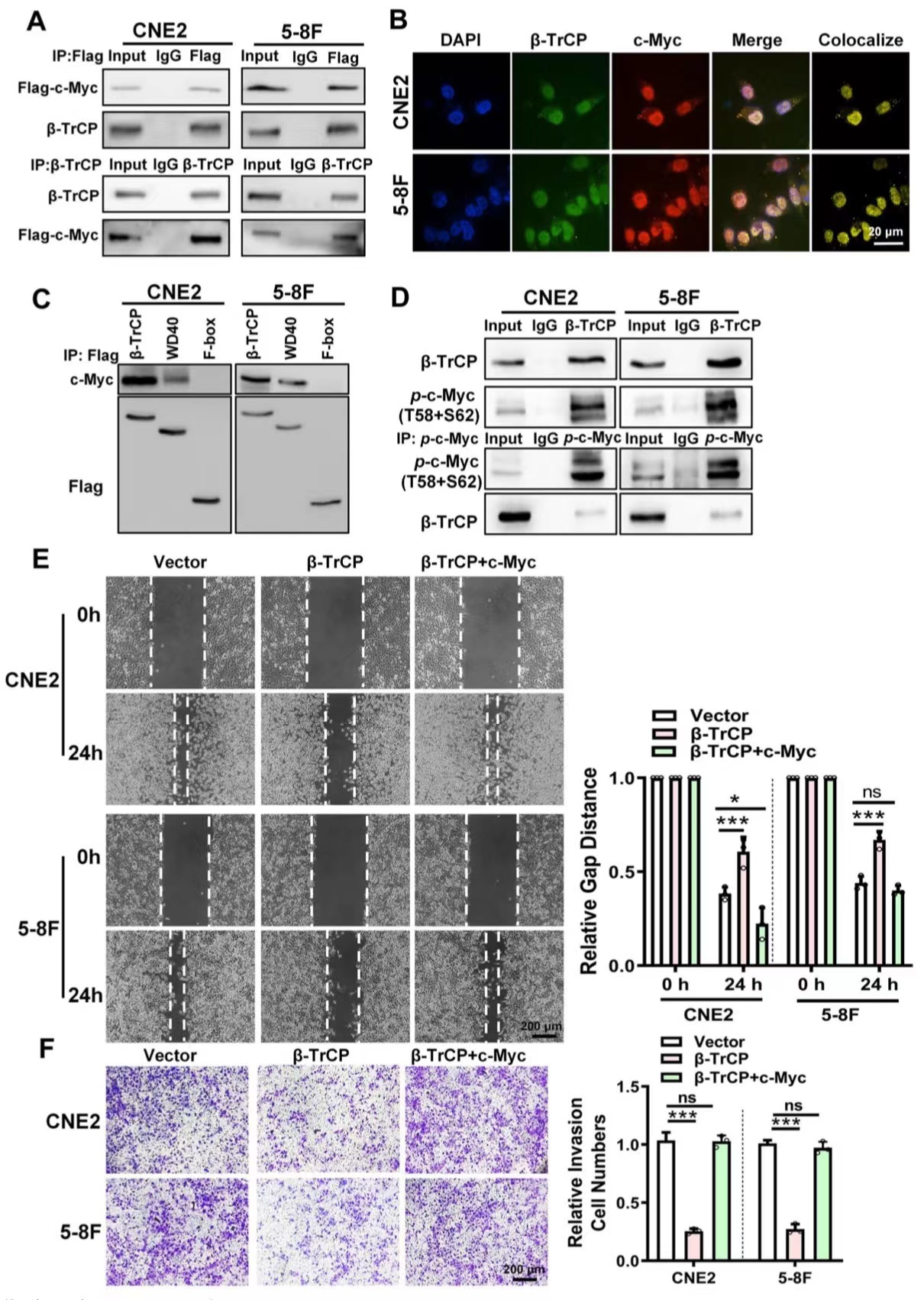
图4. c-Myc是β-TrCP的泛素化底物
5. circPVT1阻断β-TrCP与c-Myc的结合并抑制c-Myc泛素化
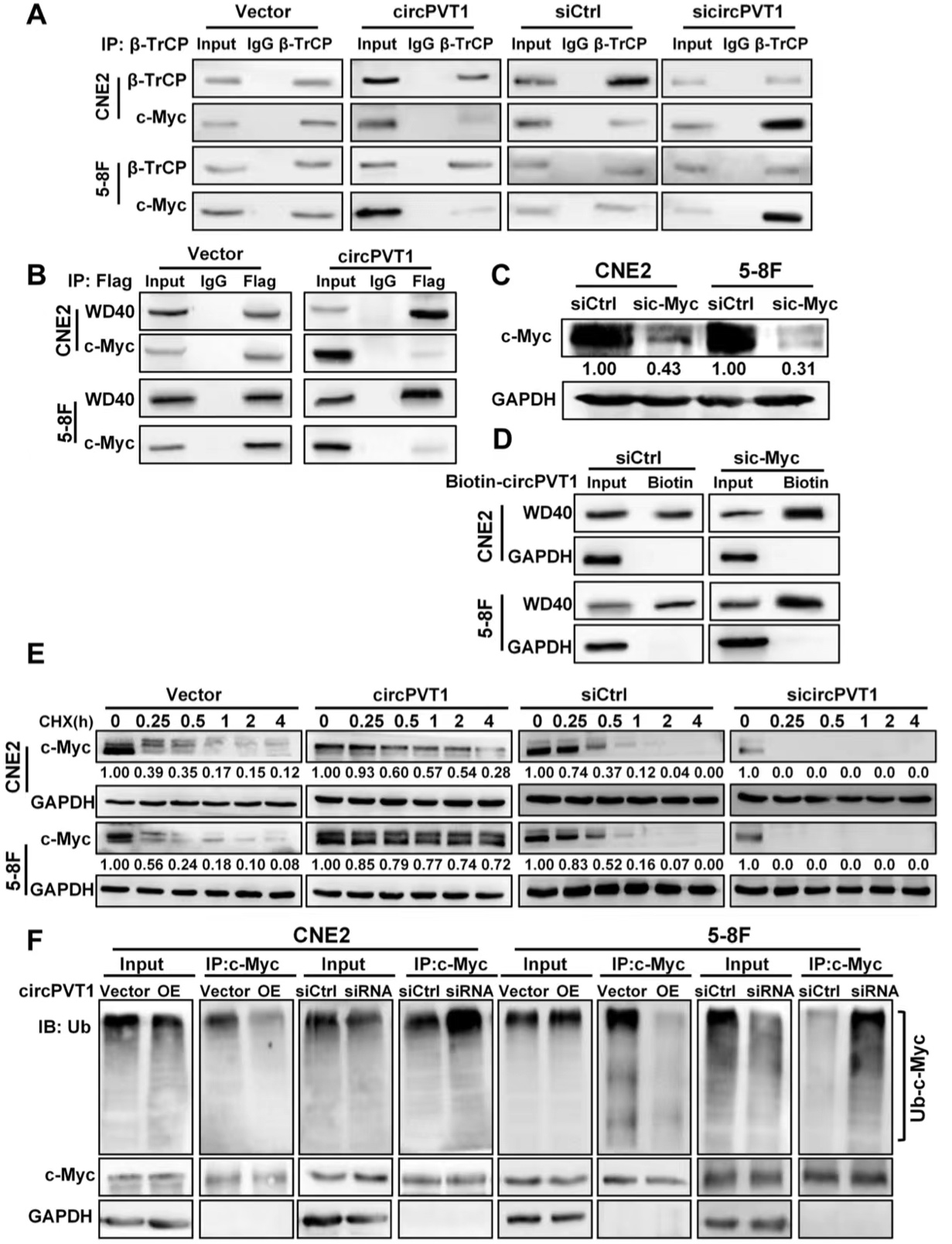
图5. circPVT1阻断β-TrCP与c-Myc的结合并抑制c-Myc泛素化
6. circPVT1通过调节细胞黏附和细胞骨架重塑促进鼻咽癌细胞的迁移和侵袭
为了进一步探索下游基因,作者使用质谱仪检测circPVT1过表达后的蛋白质组图谱,对鉴定出的231个蛋白进行生物学功能分析,发现大部分与细胞粘附、细胞连接、细胞骨架相关。作者还通过上游因子分析发现,这其中与受c-Myc调控的蛋白不在少数。因此,原子力显微镜检测显示,过表达后的NPC细胞硬度和粘附性降低。进一步试验表明circPVT1可以诱导RhoA、RhoC和Vimentin的表达,而降低E-钙粘蛋白的表达,这些都是细胞黏附连接和细胞骨架重塑途径有关的几个关键分子。而c-Myc的下调则逆转了circPVT1诱导的RhoA、RhoC和Vimentin的上调,以及PVT1周围E-钙粘蛋白表达的降低。综上所述,细胞黏附连接和细胞骨架重塑是通过PVT1/β-TrCP/c-Myc轴来调节的。
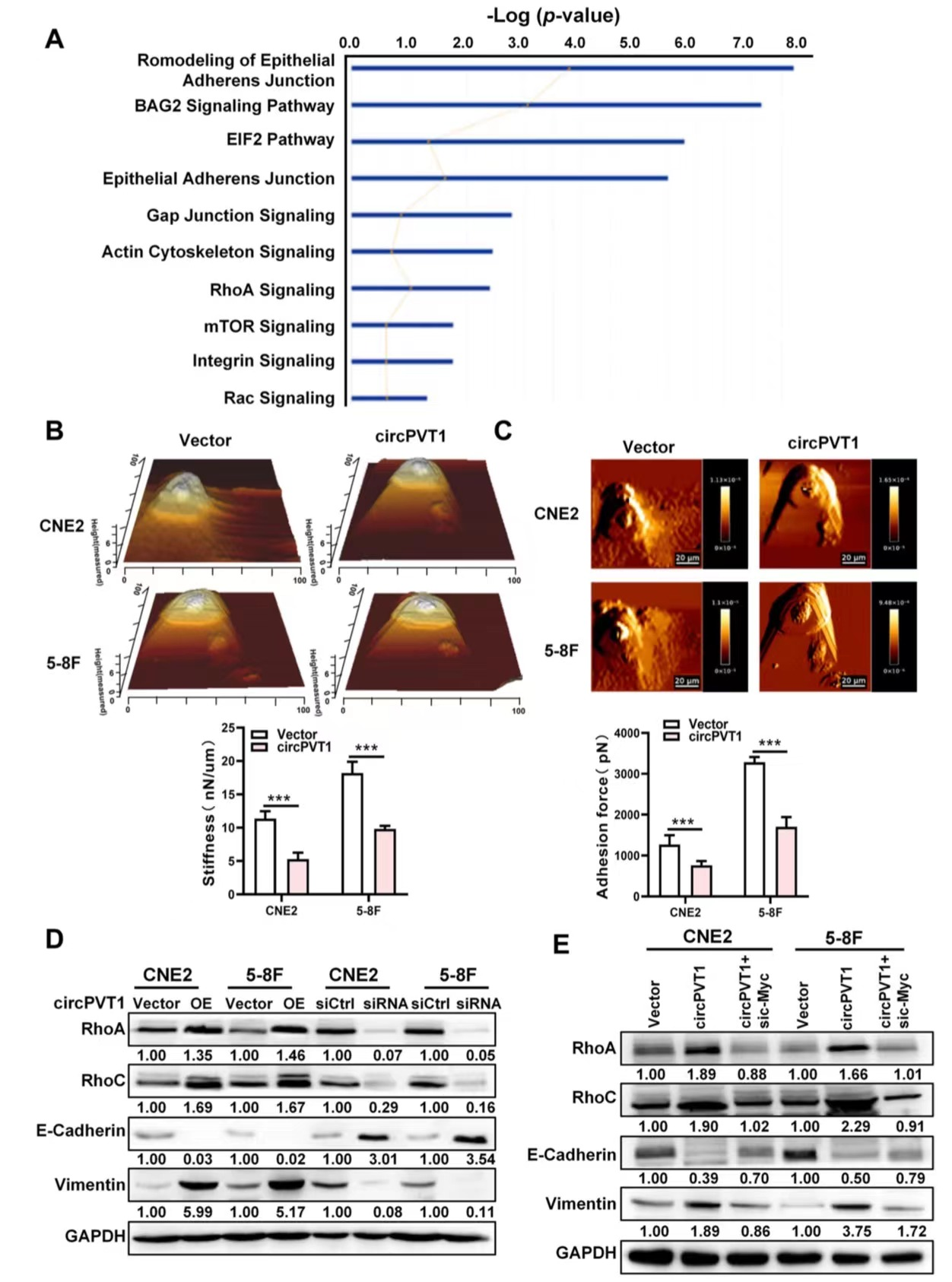
图6. circPVT1通过调节细胞粘附和细胞骨架重塑促进NPC细胞的迁移和侵袭
7. c-Myc通过上调和募集SRSF1促进CircPVT1生物合成
最后为了探明整个通路,作者运用c-Myc过表达/敲除、qRT-PCR、生信分析等方法,发现了circPVT1启动子区有三个c-Myc潜在结合位点,过表达c-Myc可以增加circPVT1的转录水平,荧光素酶报告和ChIP-qPCR结果表明c-Myc可以促进circPVT1的转录。作者利用生信预测、RIP、过表达实验证实了剪接因子SRSF1能够促进鼻咽癌细胞中circPVT1的生物发生。Co-IP实验揭示了c-Myc和SRSF1之间的相互作用,c-Myc可以作为转录因子促进SRSF1的表达。IHC结果显示circPVT1的强度与NPC组织中c-Myc和SRSF1的水平呈正相关。这些结果表明,c-Myc不仅作为促进基因转录的转录因子,而且还增强了circPVT1前体的剪接,从而通过将转录与剪接结合促进了circPVT1的生物合成。
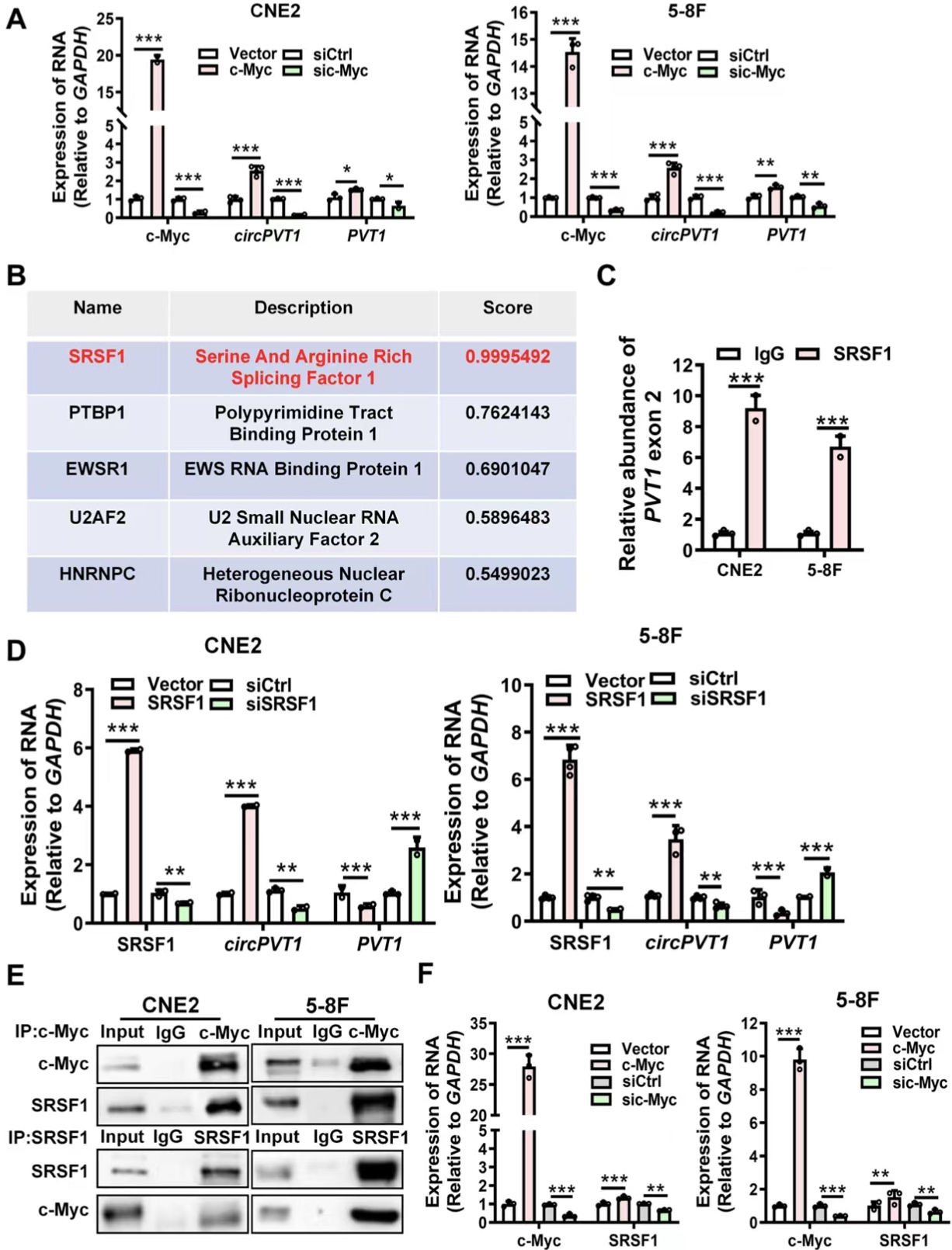
图7. c-Myc通过招募SRSF1来将转录与剪接偶联进而促进circPVT1的生成
小结

https://doi.org/10.1186/s12943-022-01659-w
参考文献
[1] Chen, Y.-P. et al. Nasopharyngeal carcinoma. The Lancet 394, 64–80 (2019).
[2] Wang, Y. et al. The influence of circular RNAs on autophagy and disease progression. Autophagy 18, 240–253 (2022).
.png)