
1、RIG-I突变与结肠癌的发展有关
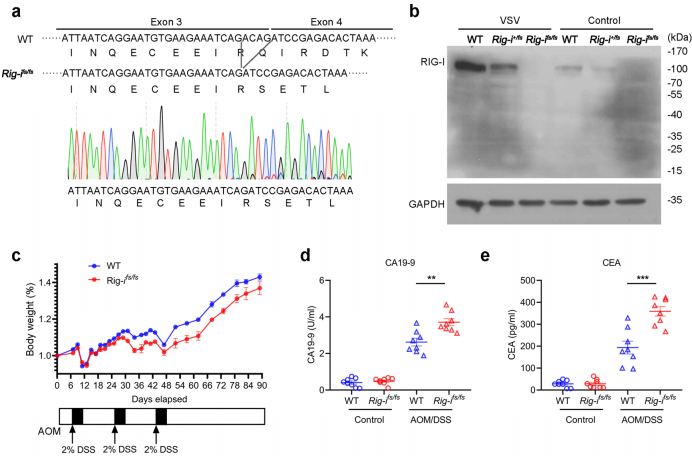
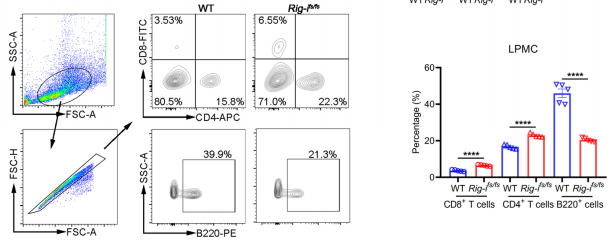
图1. RIG-I移码突变加剧结肠炎相关癌症
2、Rig移码突变增强机体炎症反应并促进CAC发展
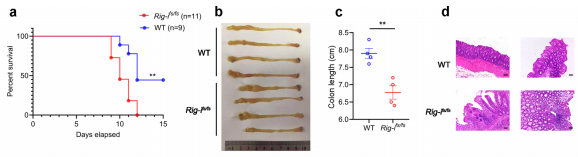
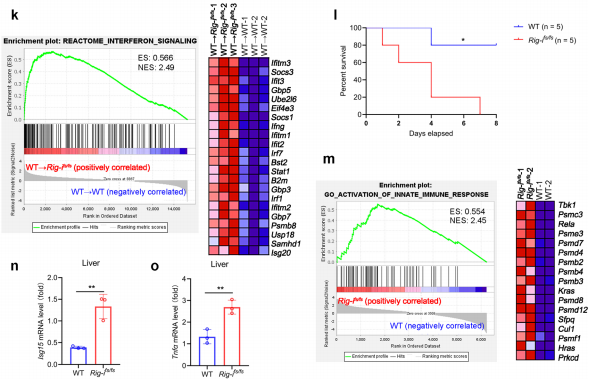 图2.RIG-Ifs/fs小鼠对实验性结肠炎的易感性增加
图2.RIG-Ifs/fs小鼠对实验性结肠炎的易感性增加3、RIG-I的移码突变通过促进I型IFN的产生限制病毒的复制
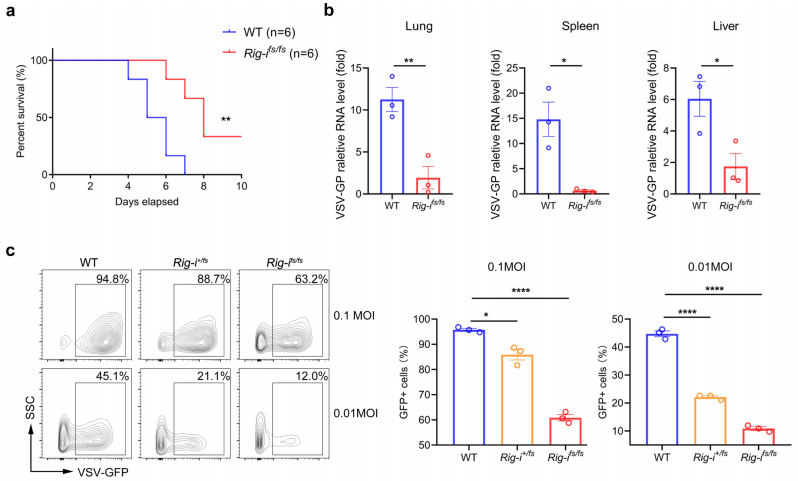
图3.RIG-I突变增强的免疫反应限制了病毒复制
4、RIG-I突变触发环状RIG-I的生成
首先,作者利用RNAfold web预测RIG-I基因的RNA结构,发现移码突变能够损坏其RIG-I前体RNA的二级结构。随后作者通过查阅已经发表的DHX9基因的CLIP-seq数据,发现DHX9作为调控环状RNA生成的关键蛋白,能够富集在RIG-I基因的Alu SINEs原件上。随后,作者也通过RNA-pulldown证实RIG-I与DHX9之前存在互作。而RIG-I的移码突变显著降低了其与DHX9的结合。由于DHX9在调控环状RNA生物发生中具有重要的作用,因此作者假设RIG-I的移码突变可以触发RIG-I转录本生成环状RNA。不出所料,作者通过RNA-seq鉴定到来源于RIG-I基因第5和12外显子的环状RNA并将其命名为CircRIG-I。该环状RNA主要存在于细胞质中,且在感染病毒的RIG-Ifs/fsMEFs中显著增加。以上结果表明,RIG-I的移码突变触发了CircRIG-I的产生。
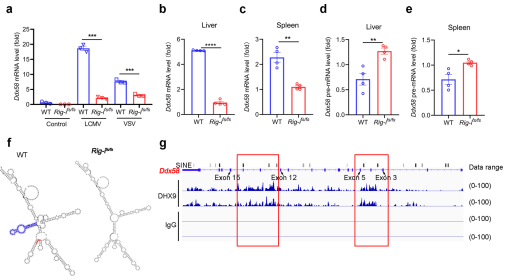
图4.RIG-I移码突变刺激CircRIG-I生成
5、CircRIG-I在结肠癌中上调并增强宿主免疫反应
为了验证CircRIG-I在组织中的表达情况,作者通过qPCR检测到CircRIG-I在结肠癌组织中高表达,并且发现溃疡性结肠癌中CircRIG-I的表达水平高于息肉样结肠癌。此外,炎症灶中CircRIG-I的表达也显著高于正常组织,这也进一步证明了CircRIG-I参与肿瘤相关的炎症反应。随后,作者为了确定CircRIG-I是否影响I型IFN的产生,通过使用shRNA在不影响线性的RIG-I的情况下选择性地敲除CircRIG-I。实验结果显示,当VSV感染时抑制CircRIG-I表达在一定程度上削弱了野生型或RIG-Ifs/fs MEFs对I型IFN和ISG (Ifitm2)产生的刺激作用。而在HEK293T细胞中,CircRIG-I过表达能够显著抑制病毒复制,并且增强了I型IFN的产生和其他ISGs的表达。有研究报道I型IFN的产生与IRF3的磷酸化具有非常重要的作用,因此作者又在过表达CircRIG-I的细胞中检测了IRF3的磷酸化情况。实验结果显示,在过表达CircRIG-I的细胞中,IRF3的磷酸化水平显著升高。此外,与对照细胞相比,在过表达CircRIG-I的细胞中检测到IRF3的二聚体和核积累也相应增加。综上所述,该结果确定了CircRIG-I在调节宿主先天免疫中的刺激作用。
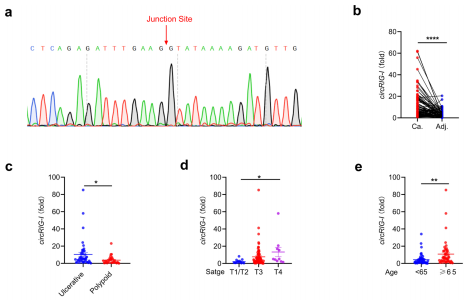
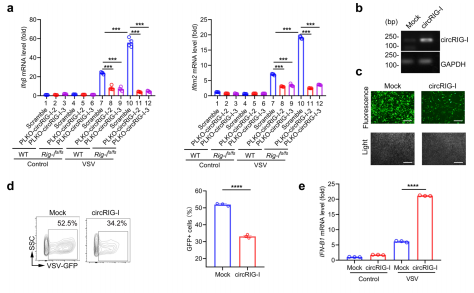
图5.CircRIG-I增强宿主固有免疫反应
6、CircRIG-I可激活DDX3x/MAVS/TRAF5/TBK1通路
为了探究CircRIG-I是否通过下游通路影响宿主免疫反应,作者通过过表达带有MS2标签的CircRIG-I进行了RNA-pulldown实验。对pulldown产物的质谱分析结果显示,DDX3x作为I型IFN信号通路的重要组成部分与CircRIG-I存在互作。为了研究CircRIG-I促进DDX3x激活的机制,作者使用免疫沉淀和质谱(MS)来鉴定CircRIG-I过表达和敲低时DDX3x相关蛋白的动态变化。利用该方法,作者鉴定出多个与之前的报道一致的DDX3x相关蛋白,包括TBK1、EIF4G1和EIF3A等。进一步验证后发现CircRIG-I促进了DDX3x与MAVS、TRAF家族(TRAF1、TRAF4和TRAF5)以及TBK1的关联。从而表明CircRIG-I通过激活DDX3x刺激IRF3介导的先天免疫信号。
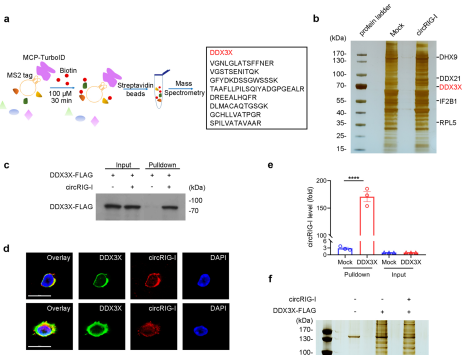
图6.CircRIG-I激活DDX3x介导的先天免疫信号
7、全反式维甲酸通过抑制CircRIG-I表达改善免疫病理
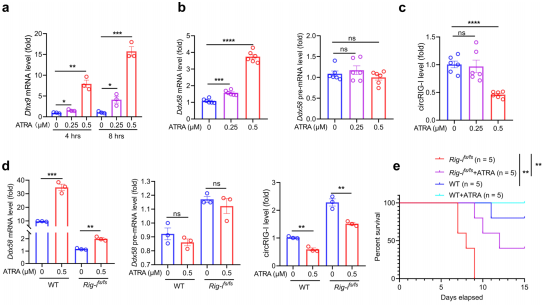
图7.全反式维甲酸缓解RIG-Ifs/fs结肠炎性病变
参考文献:
[1] Song Jia,Zhao Wei,Zhang Xin et al. Mutant RIG-I enhances cancer-related inflammation through activation of circRIG-I signaling.[J] .Nat Commun, 2022, 13: 7096.
转载请联系邮箱授权:circRNA@163.com
.png)