2021年,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)陈玲玲研究组在Molecular Cell上发表相关研究,首先比较了不同方式体外合成环形RNA的效率及免疫原性,发现T4 RNA连接酶合成的环形RNA具有较低的免疫原性。为进一步应用体外合成的环形RNA奠定了重要基础,也为进一步研发基于环形RNA技术的核酸适配体和基因治疗领域带来可期前景[3]。环状RNA作为mRNA 2.0,具有相对于mRNA更大的开发潜力,环状RNA的体外制备和环化产物的翻译潜能是其转化的基础。

为检测影响环状RNA蛋白表达的影响因素,缩短高通量设计-构建-测试周期,作者设计了以BsmBI限制性内切酶位点为连接位点的,包含六个主要部分的质粒系统(Golden Gate8和Gibson cloning9)。先前研究表明,环状RNA可以触发体内免疫反应,这可以通过用m6A修饰环状RNA来避免。m6A掺入也不会对环状RNA翻译产生不利影响。为了最大限度地提高 环状RNA 的蛋白质翻译效率,作者主要探讨了影响环状RNA蛋白产量的以下五个因素:
因素1. 核酸序列的方向性和疤痕(scar)序列的影响
虽然,IRES直接位于基因上游具有较高的翻译效率,内含子剪接疤痕对IRES介导的环状RNA翻译影响不大。此外,通过添加50 nt间隔子,将IRES和相关基因从剪接疤痕中分离出来,可以改善环状RNA的翻译(图1)。
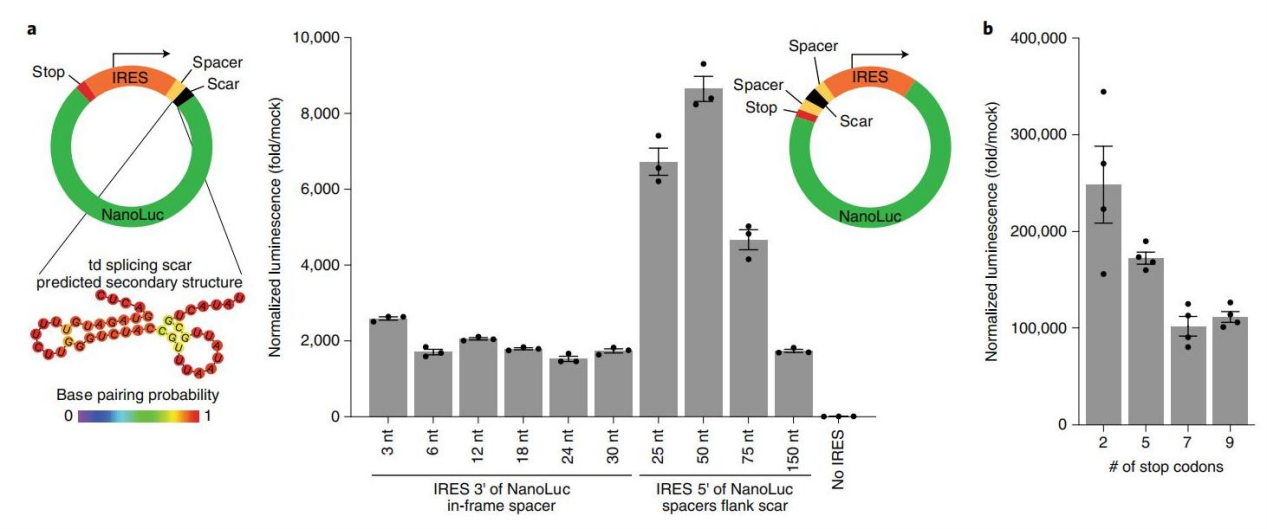
图1. 拓扑结构和间隔序列对蛋白翻译影响
因素2和因素3. 5′和3′UTR可以提高circRNA的翻译
mRNAs中的5′和3′UTR可以招募RNA结合蛋白(RBPs),从而实现强大的翻译以及转录后调控的各个方面。作者在环状RNA上验证发现,5′UTR区域增加PABP基序和eIF4G招募适体对翻译的改善最大,用短或全长形式的HBA1 3′UTR替换3′UTR端间隔区域也可以显著提高翻译强度。
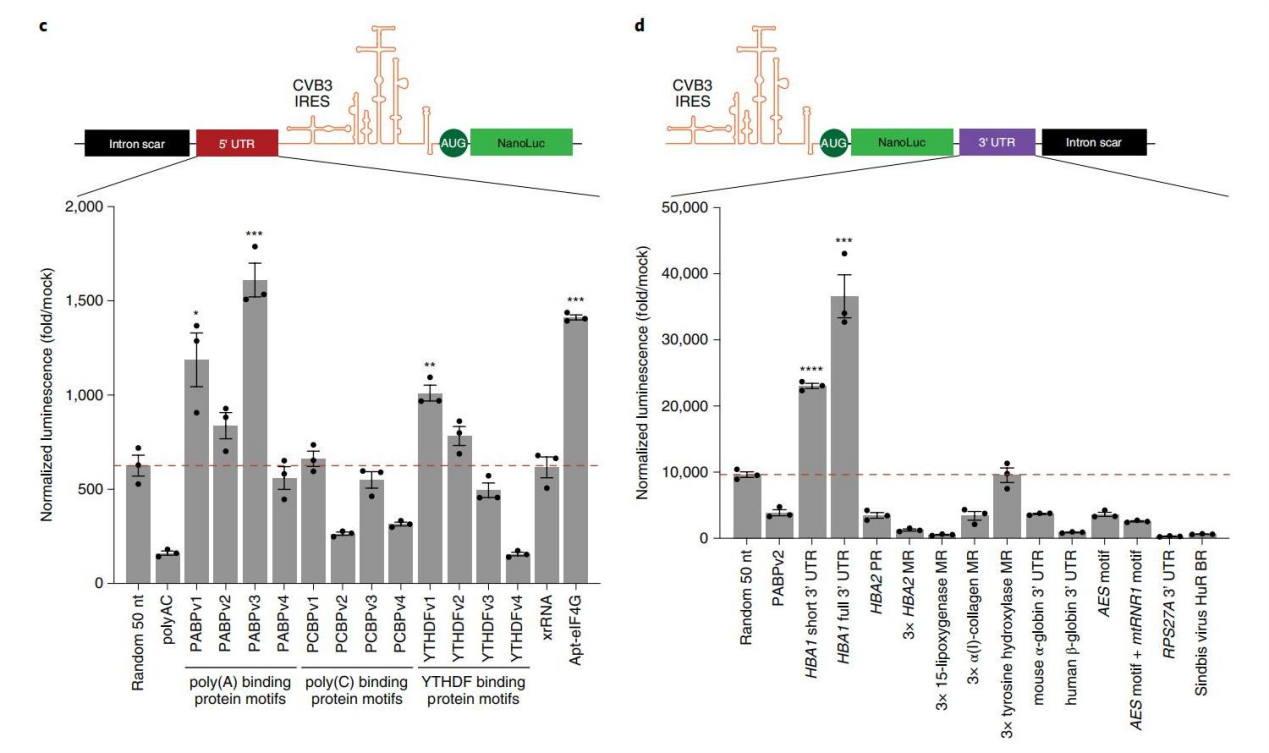
图2. 5′和3′UTR序列对蛋白翻译的影响
因素4. 内部核糖体进入位点(IRES)
IREs是一种多样且高度结构化的RNA区域,以iCVB3为例,其结构可分为七个区域,任一结构域的缺失或突变均会影响环状RNA的翻译,全长IRES对于高效的环状RNA翻译是必要的。
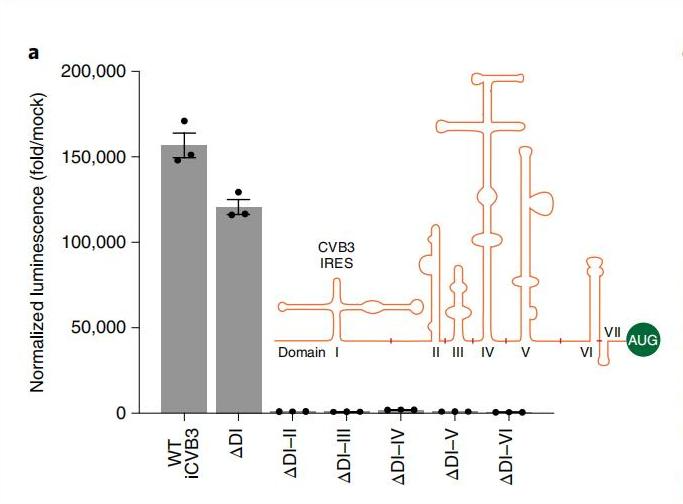
图3. IRES结构域缺失对蛋白翻译的影响
因素5. 翻译起始因子eIF4G的招募适体(Apt-eIF4G)
eIF4G在启动环状RNA中IRESs的翻译中起着关键作用,作者设计了iCVB3的合成变体,在其中合理地插入Apt-eIF4G,结构域IV的十字形结构最容易插入Apt-eIF4G。在结构域IV的远端和近端环中分别插入Apt-eIF4G的synIRES06和synIRES08均显示出比野生型iCVB3显著改善的翻译。
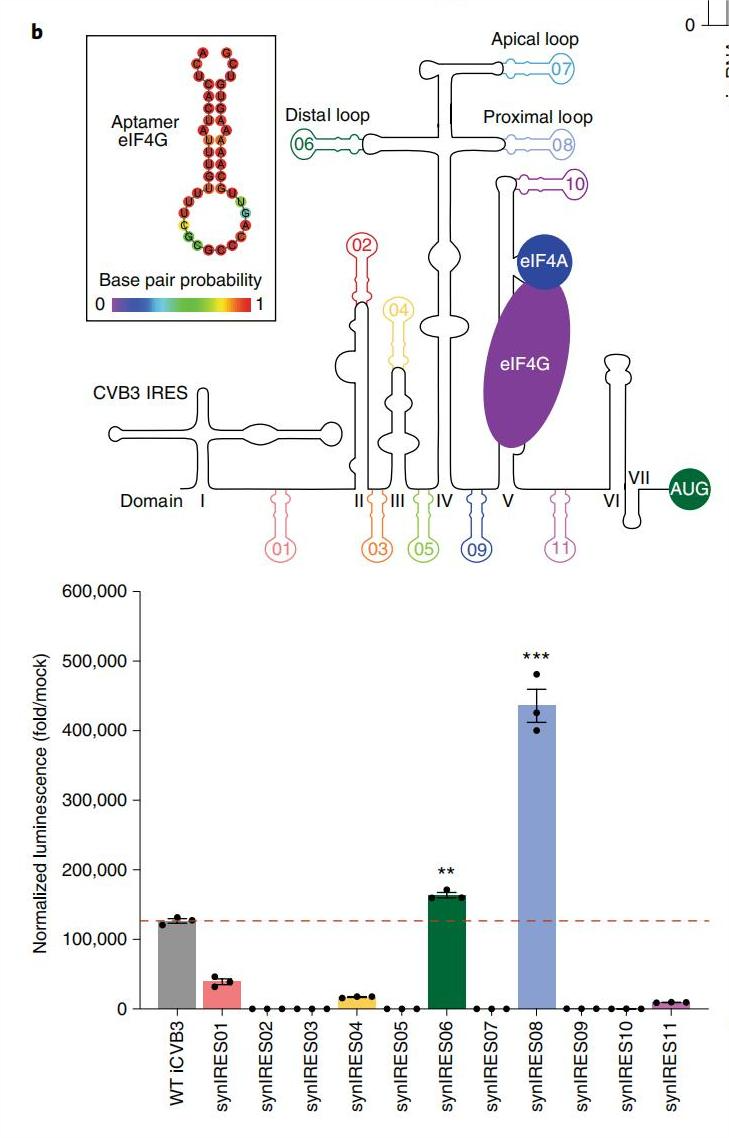
图4. Apt-eIF4G插入位置对蛋白翻译的影响
作者通过优化和组合以上影响因素,对影响翻译的最佳条件,在HeLa、HepG2和HEK293T细胞中进行了筛选。体外条件下,在Hela细胞中成功将 环状RNA 翻译的蛋白质产量提高了数百倍(NanoLuc荧光倍数增加224倍,AkaLuc荧光倍数增加200倍以上),在体外具有比线性 mRNA 更高的翻译效率。
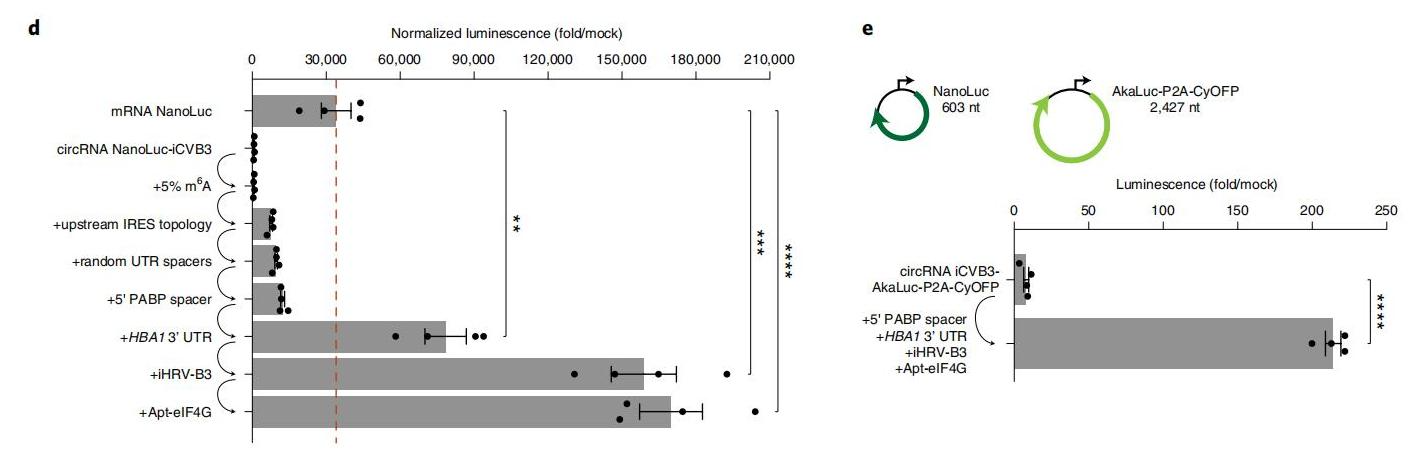
图5. 优化结构的环状RNA翻译效率对比(Hela细胞)
随后,作者使用优化的环状RNA结构,分别设计了编码荧光素酶 NanoLuc和人促红细胞生成素(hEPO)的蛋白质。优化后的工程化环状RNA可以重复给药,且具有相对于mRNA更加稳定持久的蛋白表达。
参考文献:
[1]. Chen, Y . G. et al. Sensing self and foreign circular RNAs by intron identity. Mol. Cell 67, 228–238 (2017).
[2]. Chen, Y.G., et al., N6-Methyladenosine Modification Controls Circular RNA Immunity. Mol Cell, 2019. 76(1): p. 96-109 e9.
[3]. Liu et al., RNA circles with minimized immunogenicity as potent PKR inhibitors, Molecular Cell (2021), https://doi.org/10.1016/j.molcel.2021.11.019
[4]. Fan, X., Yang, Y., Chen, C. et al. Pervasive translation of circular RNAs driven by short IRES-like elements. Nat Commun 13, 3751 (2022). https://doi.org/10.1038/s41467-022-31327-y
.png)