结直肠癌是全球发病率第二,死亡率排名第三的恶性肿瘤。常用的放化疗治疗方法产生的耐药性严重限制该方法的治疗效果,探索结直肠癌发生发展的综合分子机制是改善结直肠癌患者预后的关键。
Ras相关的GTP结合蛋白,包括RRAGA、RRAGB、RRAGC和RRAGD(也称为Rags),被认为是mTORC1信号的主要激活因子,RRAGA /B与RRAGC /D结合形成异源二聚体,将mTORC1招募到溶酶体膜上[1]。mTORC1细胞生长和存活的重要调节器,已有研究发现,活化的mTORC1可通过磷酸化翻译起始因子4E-BP1和核糖体蛋白S6K促进蛋白质和脂质合成[2]。mTORC1信号在癌症中通常非常活跃,这不仅促进了肿瘤的持续生长,而且调控肿瘤细胞抵抗化疗。
2022年6月23号,南方医科大学病理科李学农教授在Molecular Cancer(IF 41.444)发表研究circEXOC6B interacting with RRAGB, an mTORC1 activator, inhibits the progression of colorectal cancer by antagonizing the HIF1A-RRAGB-mTORC1 positive feedback loop,发现circEXOC6B通过拮抗HIF1A-RRAGB-mTORC1正反馈环,抑制结直肠癌的进展,增强结直肠癌细胞对5-氟尿嘧啶的化疗敏感性,circEXOC6B是结直肠癌治疗的可能靶点。

首先,通过高通量测序筛选,作者在结直肠癌及其癌旁组织中发现显著下调的circEXOC6B,并在另外一个GEO数据集(GSE77661)中,通过回顾性分析也发现circEXOC6B的下调。在78对癌和癌旁组织中,通过qPCR验证circEXOC6B的低表达,获得与测序一致的结果。
作者使用特异性靶向circEXOC6B的siRNA干扰CRC细胞中circEXOC6B的表达,并使用circEXOC6B过表达载体(吉赛生物过表达载体系统)上调circEXOC6B的表达。随后,细胞功能实验发现,circEXOC6B具有抑制CRC细胞增殖、克隆、细胞周期的作用。
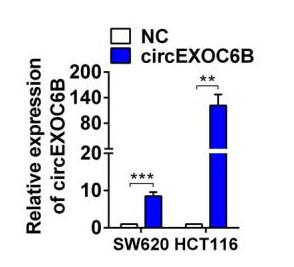
circEXOC6B过表达效果
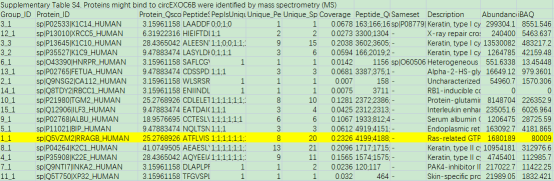
进一步进行机制探索,作者在CRC细胞中进行pull-down实验,发现在35-40kDa存在circEXOC6B结合的独特肽段。随后,作者对下拉蛋白产物进行质谱分析(表1),在肽段比对数较高的蛋白中筛选到大小合适的RRAGB作为候选蛋白。
表1.质谱结果差异表达筛选
作者使用catRAPID数据库(RNA-Protein),预测RRAGB与circEXOC6B的可能结合位点,结果显示,RRAGB中最可能与circEXOC6B结合的区域位于250 aa位点附近。通过构建翻译不同domain的线性载体,使用RIP验证了RRAGB的223–346 aa区域负责与circEXOC6B的相互作用。如图1所示,有趣的是,目标domain包含RRAGB与RRAGC /D异源二聚体的结合位点(235–306 aa,NCBI数据库)。CircEXOC6B可竞争性干扰RRAGB–RRAGC /D异源二聚体的形成。
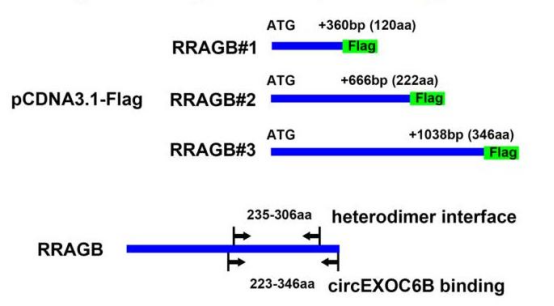
图1.circEXOC6B在RRAGB上的结合区域
作者推断circEXOC6B可能通过干扰异源二聚体的形成来抑制mTORC1途径,在体外和实体瘤内验证了circEXOC6B对mTORC1信号通路的抑制作用。功能挽救实验进一步证明circEXOC6B通过竞争性结合RRAGB抑制mTORC1途径促进CRC生长的推断。
如图2所示,作者筛选并验证了转录因子HIF1A位于RRAGB的启动子区域的结合位点,确定HIF1A可以与RRAGB的启动子区域(P2)结合以促进其转录。因此,HIF1A-RRAGB-mTORC1正反馈回路驱动CRC进展,circEXOC6B阻断这种正反馈环,从而抑制结直肠癌的生长。
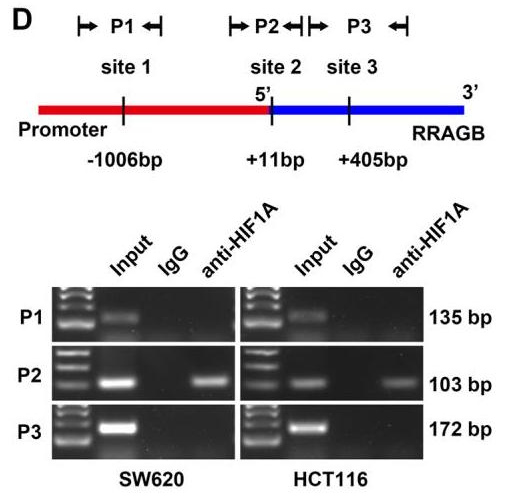
图2.HIF1A 结合位点(P2)参与转录调控
5-FU是结直肠癌的常用化疗药物,在治疗过程中因固有或获得性耐药性的存在而使药效降低。已有研究证明,mTORC1和HIF1A通路的激活是产生5-FU耐药性的关键原因。作者发现,在5-FU敏感细胞系RKO、LoVo、HCT116和HT-29中circEXOC6B的表达高于5-FU非敏感细胞系SW620,较高的circEXOC6B表达使CRC细胞对5-FU治疗更敏感(图3)。
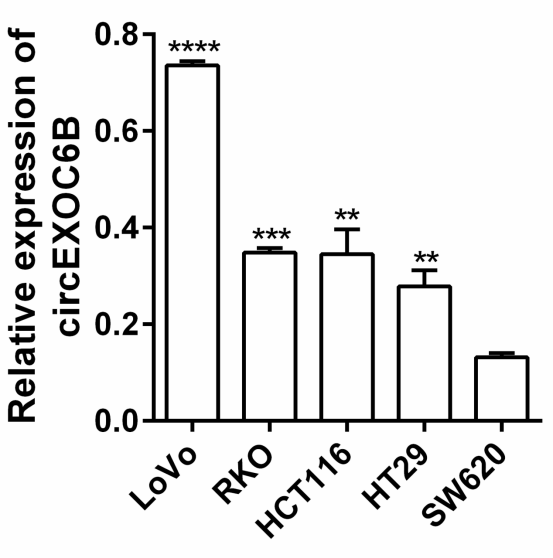
图3. 5-FU敏感和非敏感细胞的circEXOC6B表达情况
总的来说,本研究揭示了HIF1A-RRAGB-mTORC1正反馈回路的存在,该回路驱动CRC的发展。circEXOC6B可以结合到RRAGB的异源二聚体形成位点,破坏其与RRAGC /D的相互作用,从而抑制HIF1A-RRAGB-mTORC1正反馈(图4)。因此,circEXOC6B抑制结直肠癌的生长并增加5-FU诱导的结直肠癌细胞凋亡。这些结果为HIF1A和mTORC1通路之间的串扰提供了新的见解,并指出了阻断CRC进展的潜在治疗靶点。
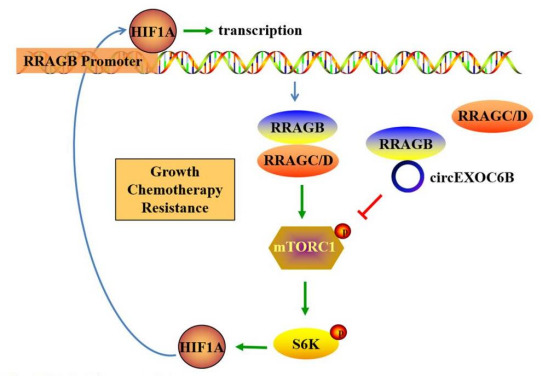
图4. circEXOC6B参与CRC的模式图
原文链接:https://doi.org/10.1186/s12943-022-01600-1
参考文献:
- Sekiguchi T, Hirose E, Nakashima N, Ii M, Nishimoto T. Novel G proteins, rag C and rag D, interact with GTP-binding proteins, rag a and rag B. J Biol Chem. 2001;276(10):7246–
- Ma XM, Blenis J. Molecular mechanisms of mTOR-mediated translational control. Nat Rev Mol Cell Biol. 2009;10(5):307–18.
.png)