6月17日,Cell Research杂志在线发表了一项重要的circRNA研究工作,报道发现来自Zbtb7a基因(别名POKEMON)的一个circRNA与POKEMON在肿瘤中的作用方式完全相反:POKEMON基因是一种抑癌基因,而这个circRNA分子却起到类似癌基因的作用!文章的通讯作者是哈佛医学院Beth Israel Deaconess医学中心(BIDMC)的Pier Paolo Pandolfi教授[1]。2016年的那篇融合基因来源的circRNA具有癌基因功能的Cell文章的通讯作者正是Pier Paolo Pandolfi教授。(Title:Oncogenic Role of Fusion-circRNAs Derived from Cancer-Associated Chromosomal Translocations)。

Paolo Pandolfi教授团队曾发现Zbtb7a基因(别名POKEMON)在间质来源细胞癌变过程中可抑制癌基因Dlk1和Sox9,起到抑癌基因的作用[2],因此提出假设,该基因来源的circRNA也许在间质细胞癌变作用中也有功能。PCR扩增仅发现了来自第二外显子的一个circRNA,将其命名为circPOK。细胞功能实验中发现circPOK与Pokemon蛋白的功能完全相反,Pokemon蛋白已知是一种抑癌基因,但circPOK却具有促癌作用。进一步的分析表明circPOK与Pokemon蛋白发挥功能的途径是不相关的,它们的功能是独立的。RNA Pull-down分析找到了circPOK相互作用蛋白,是一些细胞核内的RNA和DNA双特异性的结合蛋白,其中ILF2/ILF3是已知的具有促癌功能的分子。作者最后分析了circPOK与ILF2/ILF3相互作用的方式及发挥促癌作用的机制,表明circPOK结合ILF2/ILF3可改变其诱导下游基因表达的倾向性,促进IL-6,VEGF等因子的表达。
发现与验证circPOK
作者设计了一系列的反向引物,在间充质干细胞(MSC)中分析PCR产物,最终只鉴定到Zbtb7a基因的第二外显子的一个circRNA,将其命名为circPOK。 两对不同的反向引物也仅能鉴定出同一个circRNA分子,它可以耐受RNase R的消化作用。小鼠MSC中进行绝对定量,表明circPOK比其线性产物LinPOK的含量要低很多。
为分析circPOK的细胞定位,作者设计了一种新的原位杂交体系:circFISH。该技术的原理是针对circPOK的区域(第二外显子)部分设计为绿色标记的探针,Zbtb7a基因 的外显子1和3的探针设计为红色标记。如果所杂交的分子是LinPOK,它可同时被绿色和红色探针杂交,因此可表现为绿色与红色共定位的信号,而当杂交的分子是circPOK,就只能显示绿色。通过双色荧光拍照后即可找出circPOK和LinPOK的定位信息。为确认该杂交体系信号的可靠性,作者还在杂交实验中增加了RNase R消化的对照,证明所获得的信号是circPOK。
在原位杂交的结果中,可以看到circPOK和LinPOK在胞质和核中均有定位,分离胞质与核组分后qPCR检测结果表明小鼠MSC或HS5细胞中circPOK和LinPOK在胞质与核中均有分布。
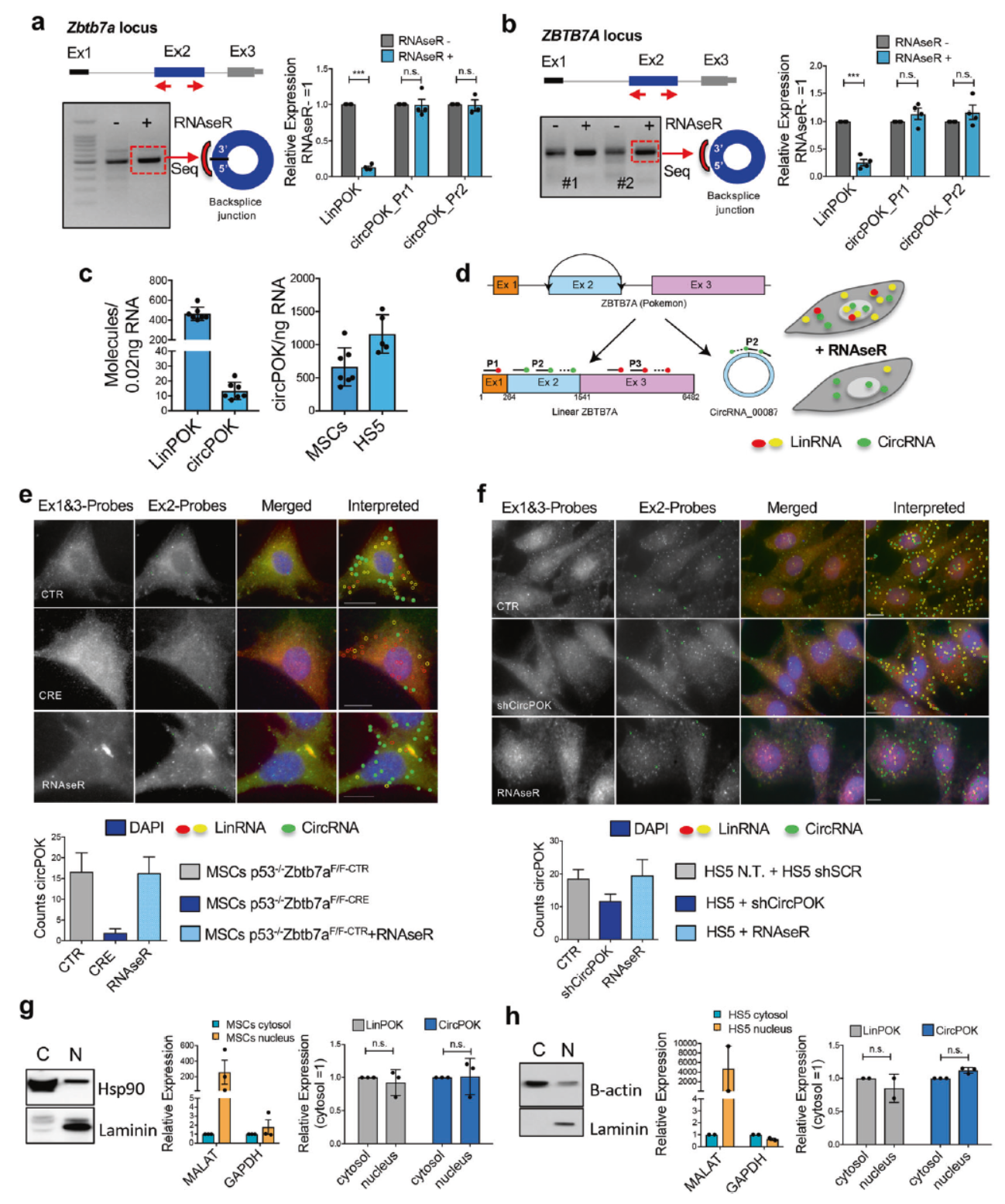
图1 circPOK的发现与鉴定 ([1])
Pokemon蛋白和circPOK功能完全相反
作者早期的研究表明未分化的癌变间质细胞中Pokemon蛋白的表达量显著低于正常的纤维组织,qPCR检测后证明未分化的癌变间质细胞中circPOK表达却并未降低,骨肉瘤中circPOK表达也相对高于LinPOK。在他们早期的研究中曾经构建过Zbtb7a基因第二外显子条件性敲除的小鼠模型[2]。在这种小鼠中,如果细胞内表达了Cre酶,可以通过重组反应删除两段LoxP位点夹带的中间片段,因此在作者所构建的小鼠模型(p53−/−, Zbtb7a_Ex2F/F)中,表达Cre酶后可以同步敲除Zbtb7a基因的蛋白产物Pokemon蛋白和circPOK。
作者分离了p53−/−, Zbtb7a_Ex2F/F小鼠的MSC细胞,先通过病毒载体表达了Cre酶,实现第二外显子的敲除(Pokemon蛋白和circPOK被同时敲除了),然后分别回补表达Pokemon蛋白和circPOK,这样就可以分析Pokemon蛋白和circPOK的功能了。分别将表达Pokemon蛋白或circPOK以及相关的对照细胞分别注射小鼠,分析形成肿瘤的大小,结果发现,过表达Pokemon蛋白可以抑制肿瘤的形成,但过表达circPOK却可以促进肿瘤的生长。

图2 Pokemon蛋白和circPOK功能完全相反 ([1])
circPOK具有癌基因的功能
为进一步确认circPOK的功能,作者构建了shRNA进行分析,主要的实验设计师分别构建靶向外显子2或3’UTR的shRNA,转染p53−/− MSCs细胞后看克隆形成的速率。结果显示干扰3’UTR(仅干扰LinPOK)可显著促进克隆形成效率,但干扰外显子2的相对低一些,这可能是因为同步干扰了LinPOK和circPOK的叠加效果。
作者也设计了直接靶向接口位置的shRNA,结果表明该shRNA可显著降低circPOK但对LinPOK和Pokemon蛋白没有明显影响,这些shRNA不仅对胞质中的circPOK有效果,也能敲低核内的circPOK。shRNA可显著降低p53−/− MSCs细胞的增殖,但对已经敲除了circPOK的没有明显影响(排除非特异性的影响)。
除了shRNA,作者还尝试了LNA-Gapmers,细胞转染两种不同的靶向circPOK的LNA-Gapmers后能够明显降低circPOK的表达量,但对LinPOK影响不是很大,这些LNA-Gapmers能够较明显的抑制p53−/− MSCs细胞的增殖。LNA-Gapmers在细胞内的半衰期比较短,这也许是该实验结果不是特别明显的一个原因。
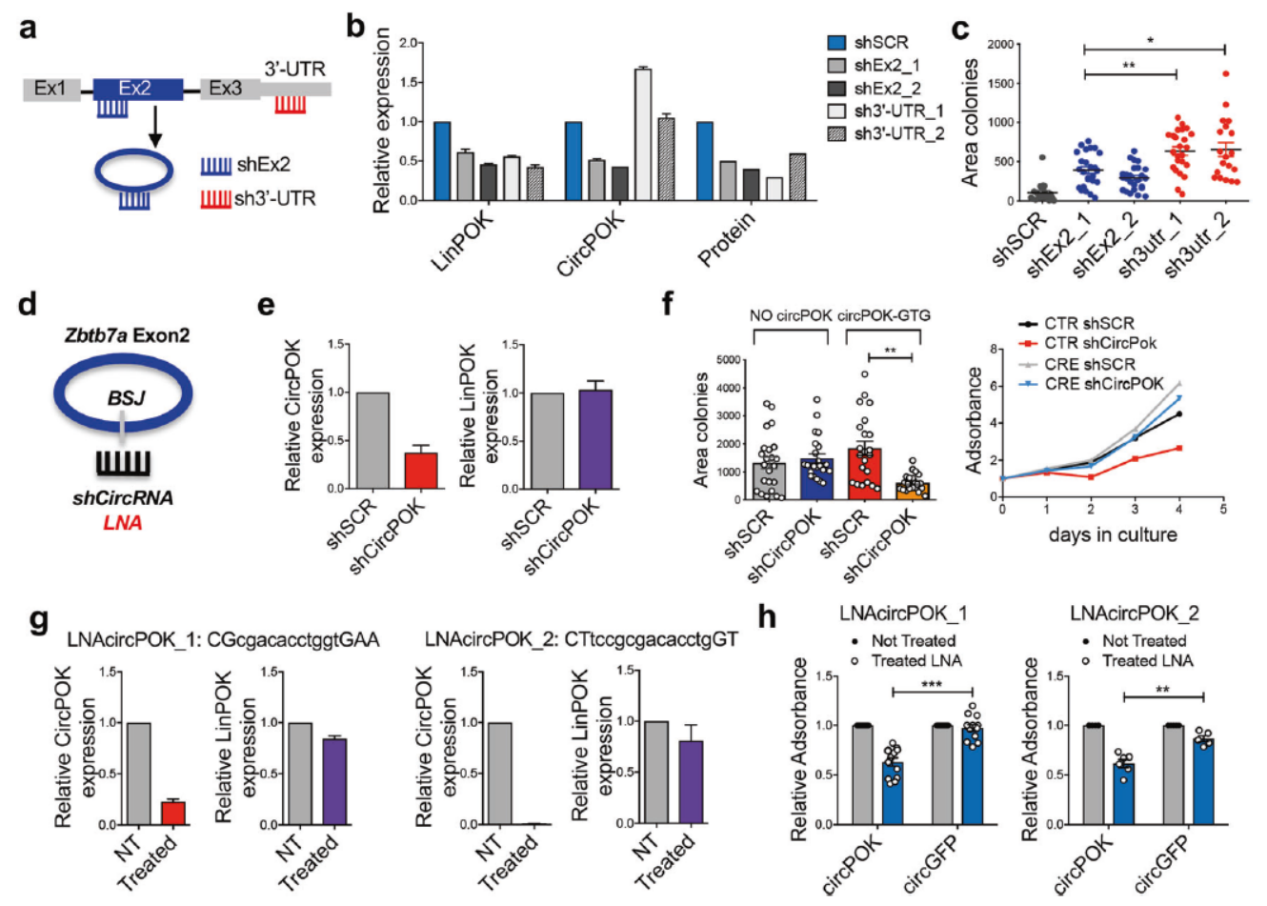
图3 circPOK具有癌基因作用 ([1])
circPOK功能机制
circPOK具有促癌的功能,那么它是通过什么机制发挥功能的呢? circPOK与Pokemon蛋白的功能相反,那么有没有可能是circPOK通过结合某种miRNA分子,间接抑制了Pokemon蛋白的表达?这个听起来有些不同寻常,作者的做法是过表达circPOK后检测Pokemon蛋白的量,如果有这种作用方式,那么一定可以表现出Pokemon蛋白的降低,但结果表明过表达circPOK并不影响Pokemon蛋白的含量。
circPOK有没有可能编码多肽而被翻译?序列分析表明circPOK的确存在一个跨接口的ORF,该ORF与Pokemon蛋白的其实密码子一致,但其终止密码子是由环化后形成的,如果存在circPOK的翻译产物,那么一定可以通过能识别Pokemon蛋白N端的抗体通过Western检测到主带之外的其他条带,但作者没有在他们的实验体系中检测到主带之外的任何条带。此外,作者还从Polysome的组分中进行QPCR检测,也没有扩增到circPOK。因此作者得出结论,circPOK在MSC中不被翻译。
另一种报道比较多的circRNA功能机制是结合RNA结合蛋白(RBP)。作者通过体外转录后化学修饰的方法获得生物素标记的circPOK探针,然后进行RNA Pull-down实验,捕获的组分进行质谱分析,结果发现了一些互作蛋白,其中一些是可以同时结合RNA或DNA的蛋白,如ILF2和ILF3。ILF2和ILF3具有癌基因的作用,那么circPOK是不是通过ILF2和ILF3实现促癌的功能的?ILF2和ILF3蛋白的抗体RIP实验证明了circPOK的确可以与它们相互作用。 circFISH与免疫荧光共定位分析也证明circPOK与ILF3在细胞核内存在共定位。ChIRP (chromatin isolation by RNA purification) 实验证明了circPOK与ILF2和ILF3在染色质中存在共定位。
circPOK与ILF2/ILF3的结合是否参与调控与间充质细胞癌变进程相关的基因的转录表达?ELISA实验表明在过表达circPOK的细胞中VEGF和IL6的表达水平有所升高,血管生成的比例也有所增高(CD31阳性的细胞增多)。分别干扰ILF2和ILF3可显著降低对应细胞所形成的肿瘤大小及其中CD31阳性细胞的比例。
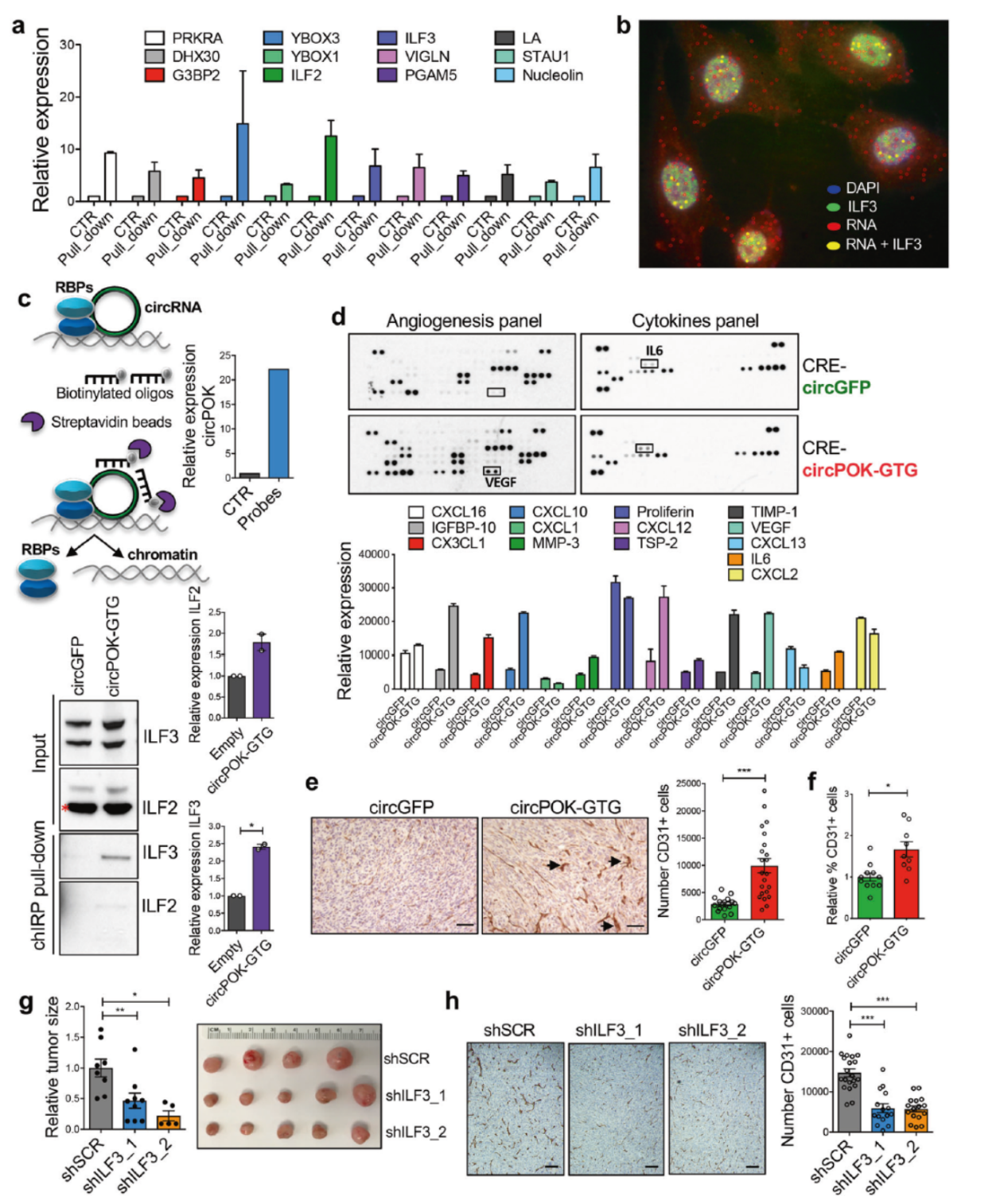
图4 circPOK通过与ILF2和ILF3相互作用发挥功能 ([1])
circPOK是ILF2/ILF3的共活性因子
上述结果表明circPOK与ILF2/ILF3的相互作用是circPOK发挥功能的途径之一,那么这一相互作用对于ILF2/ILF3是怎样的呢?也就是circPOK是如何影响或调控ILF2/ILF3的功能的?circPOK是否通过结合ILF2/ILF3促进复合物的形成或改变它们的定位?过表达或敲除circPOK的细胞中, ILF2/ILF3的相对含量并不受到影响,亚细胞定位也没有受到影响。
还有一种可能的机制是,circPOK通过与ILF2/ILF3结合,改变后者下游基因的选择性。该假设得到了实验的支持,干扰ILF2或ILF3显著降低IL-6和VEGF的表达,但过表达cricPOK则促进IL-6和VEGF的表达。靶向cricPOK的LNA-Gapmers降低IL-6和VEGF的表达。有趣的是,过表达circPOK后被ILF2抗体捕获的IL-6和VEGF的mRNA变多了。ChIRP实验也表明过表达circPOK后,circPOK和ILF2/ILF3定位于IL-6启动子的比例增加。
最后,作者描绘了circPOK与Pokemon蛋白分别发挥功能的模型:细胞中可以同时表达circPOK与Pokemon蛋白,但会存在细胞之间分布比例的差异,circPOK有结合并促进ILF2/ILF3复合物促进IL-6等基因表达的能力,而Pokemon蛋白具有抑制Dlk-1和SOX9的能力。这样在Pokemon蛋白多的细胞中,细胞增殖被抑制,反之,在circPOK多的细胞中,一些促癌的基因被表达放大,因此在细胞群体中呈现生存优势,最终诱导细胞群发生癌变。
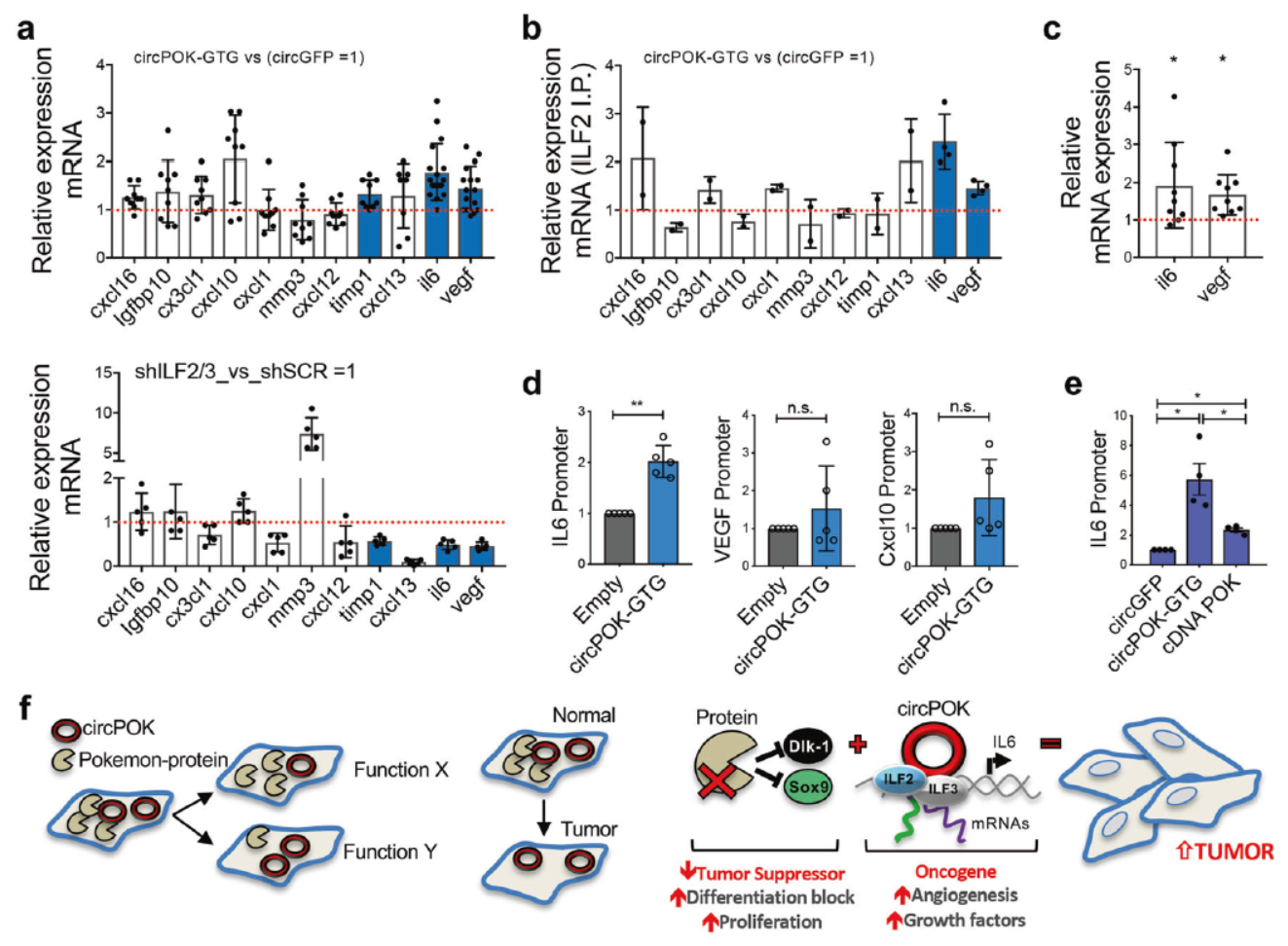
图5 circPOK结合并改变ILF2/ILF3的转录特性 ([1])
circRNA 与来源基因的功能相反是非常有趣的发现,本文的发表也为circRNA功能研究提供了新的思路和技术参考。本文的实验思路和方法与传统的circRNA研究有很大的不同,有很多值得学习的方面:
(1)作者提出的circFISH技术比较巧妙,传统的circRNA FISH实验是通过设计接口位置的互补探针进行的,这种设计无法完全避免母基因来源的信号干扰。本文的设计则同时检测母基因和circRNA,有利于明确circRNA的定位,加上RNase R消化的对照,能够更有效的检测到circRNA的定位,值得学习借鉴。但对于那些circRNA与母基因的mRNA共定位的情况,就不太适合这种技术了,因此可以在本文的实验设计基础上增加RNA Pull-down后母基因与circRNA是否可以被共同捕获的验证实验,以排除它们之间有相互作用的可能性。
(2)RNA Pull-down捕获相互作用蛋白对于circRNA功能的研究非常重要。本文的机制模型离不开相互作用蛋白的捕获和鉴定,因此有效的RNA Pull-down实验是揭示circRN功能的一把钥匙。
(3)circRNA是否能被翻译需要更多的证据支持。本文分析circRNA功能的实验中也考虑了被翻译的可能,序列分析也发现了circPOK存在跨接口的ORF序列,但从抗体杂交和Polysome捕获的分子QPCR中没有检测到阳性信号。基于这些实验,作者排除了该circRNA可被翻译的可能。但笔者认为这个结论还不是非常严谨合理,如果要验证circRNA是否能被翻译,还是需要增加过表达融合Flag标签的实验进行验证,否则还是不能完全排除这一可能,万一是因为实验体系不合理导致的假阴性结果呢?此外,circRNA能否被翻译是否存在组织或细胞特异性的可能也是有的。
参考文献:
1. Jlenia Guarnerio, Y.Z., Giulia Cheloni, Riccardo Panella, Jesse Mae Katon, Mark Simpson, Akinobu Matsumoto, Antonella Papa, Cristian Loretelli, Andreas Petri, Sakari Kauppinen, Cassandra Garbutt, Gunnlaugur Petur Nielsen, Vikram Deshpande, Mireia Castillo-Martin, Carlos Cordon-Cardo, Spentzos Dimitrios, John G. Clohessy , Mona Batish and Pier Paolo Pandolfi, Intragenic antagonistic roles of protein and circRNA in tumorigenesis. Cell Research, 2019.
2. Guarnerio, J., et al., A genetic platform to model sarcomagenesis from primary adult mesenchymal stem cells. Cancer Discov, 2015. 5(4): p. 396-409.
.png)