导语
胞外囊泡(EVs)如外泌体,含有丰富的膜系留蛋白、microRNAs和exoDNA,是液体活检中高质量核酸的主要来源之一,可为肿瘤诊疗提供所需的基因信息。然而,外周血中的外泌体既可能来源于肿瘤细胞,也会由非肿瘤细胞释放,导致肿瘤外泌体所携带的DNA信息被大量非肿瘤细胞外泌体DNA所稀释,无法准确反映肿瘤的分子特征,这也是外泌体应用于临床的一大难题。
免疫磁珠筛选是外泌体分离的主要方法之一,而肿瘤来源和非肿瘤来源的外泌体主要通过肿瘤外泌体表面的特异性分子标志物来区分。已知的四分子交联体家族成员CD63、CD9和CD81等常用于检测外泌体,却并不具有肿瘤特异性。来自安德森癌症中心的研究者们通过一系列方法筛选、鉴定了一组胰腺导管腺癌(PDAC)特异性外泌体表面蛋白质“Surfaceome”( 分子标志物组合:CLDN4、EPCAM、CD151、LGALS3BP、HIST2H2BE和HIST2H2BF),并应用这些标志物的抗体进行免疫捕获,成功地从临床样本中捕获到了PDAC来源的外泌体。此外,研究证实了富集后的外泌体可为二代测序(NGS)提供更高质量的exoDNA,提高基因突变检出率。
Surfaceome profiling enables isolation of cancer-specific exosomal cargo in liquid biopsies from pancreatic cancer patients
- 成功鉴定了胰腺癌特异性的外泌体分子标志物“Surfaceome” 分子标志物组合:CLDN4、EPCAM、CD151、LGALS3BP、HIST2H2BE和HIST2H2BF,并验证其可有效地富集到肿瘤来源的外泌体。
- 提供了另一种从血样中获取高质高量肿瘤核酸的思路,极大地提升了液体活检的灵敏度,即使在疾病早期、患者积极治疗等肿瘤负荷小的情况下亦可有效监测肿瘤DNA情况,对早期诊断、疾病全程监测均有积极意义,
- LC-MS初筛:通过LC-MS初步筛出胰腺癌外泌体几千个蛋白,然后通过分析差异表达、功能注释等进一步将范围缩小。
- 实验验证:通过western blot验证,确定最终候选蛋白,组成Surfaceome。
- 临床验证:在临床大样本中试用筛选的Surfaceome发现,KRAS检出率和MAF均大幅提高。
- 案例跟踪:跟踪分析一例治疗中的患者,肿瘤特异性外泌体的KRAS突变情况与病情进展一致,NGS分析exoDNA发现了新的BRCA2二次突变与耐药相关。
以非肿瘤细胞系(HPNE和CAF19)作为对照,选取13株人类PDAC细胞系分离外泌体,通过液相色谱-质谱法(LC-MS)分析外泌体表面及携带的完整蛋白质,初步筛选出了7086个蛋白质。以外泌体特异表达的蛋白CD81、CD9和TSG101为条件缩小范围到1057个。
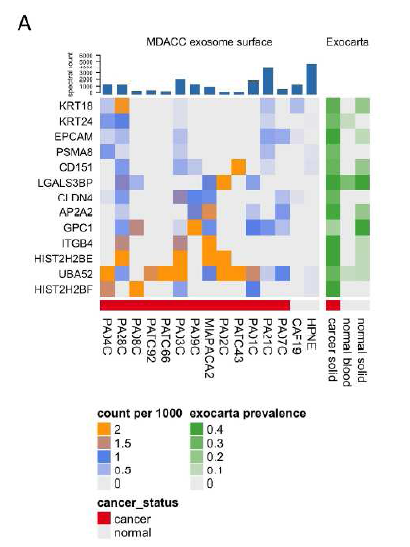
为了进一步鉴定出PDAC特异性外泌体表面标志物,获得“Surfaceome”。研究者将在至少3种PDAC细胞系中表达而在非肿瘤细胞系中的最大表达量不超过1个质谱数的蛋白作为候选的PDAC特异性外泌体表面标志物。此外,运用胞外囊泡数据库ExoCarta(一个外泌体蛋白质组数据库)注释候选蛋白,并通过实验方法进一步优化验证(如图)。
肿瘤和非肿瘤来源外泌体表面的蛋白表达情况,图中所示蛋白至少在3种PDAC细胞的外泌体表面表达而不表达或极低表达于HPNE和CAF19细胞来源的外泌体。
以非肿瘤细胞系CAF19和SC2为对照,选取三株PDAC细胞系Pa01C、Pa03C、Pa04C直接裂解或分离外泌体后进行western blot来验证候选蛋白质。结果显示,候选蛋白在所有细胞裂解物中均可检测到不同程度的表达;而在外泌体中,只在PDAC来源的外泌体中特异性或高丰度表达。例如:CD151和HistoneH2B(H2B)特异性表达于PDAC细胞系;LGALS3BP则在肿瘤来源外泌体中过表达。值得注意的是,最近报导的PDAC外泌体标志物glypican-1 (GPC1),研究者使用了四种不同的GPC1抗体均未检测到它在肿瘤来源外泌体中的表达,反而可在非肿瘤来源外泌体中检测到。通过上述实验验证,确定了最终的候选分子标志物组合:CLDN4、EPCAM、CD151、LGALS3BP、HIST2H2BE和HIST2H2BF。
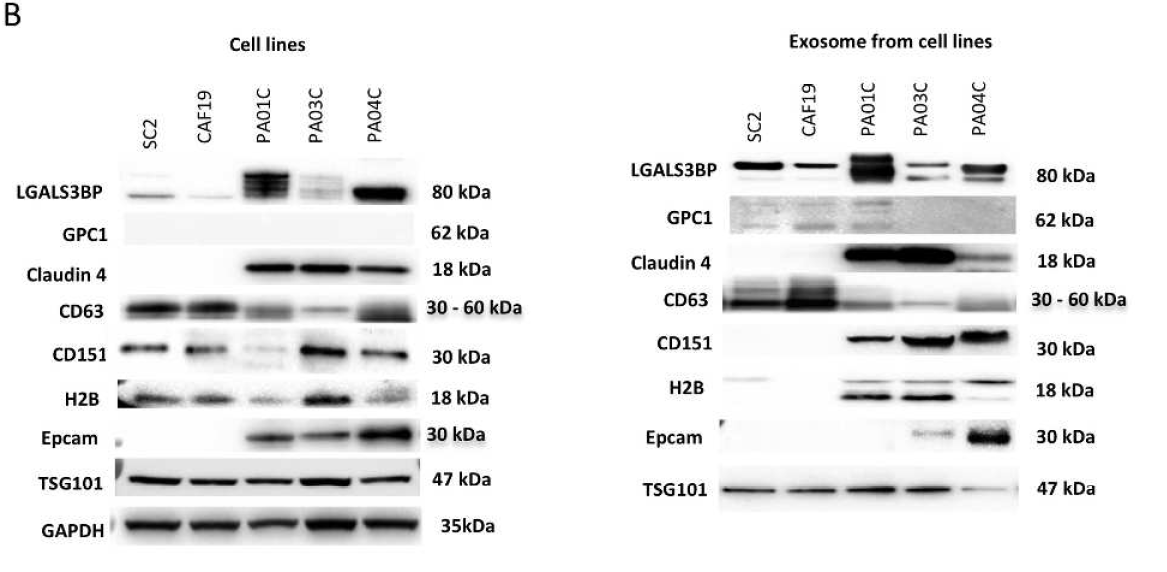 WB验证候选蛋白。左:细胞系裂解物;右:细胞系分离的外泌体。大部分候选蛋白特异性表达于肿瘤外泌体。
WB验证候选蛋白。左:细胞系裂解物;右:细胞系分离的外泌体。大部分候选蛋白特异性表达于肿瘤外泌体。
选取103名处于积极化疗间歇期的PDAC患者,收集到共173个血液样本。将136个样本直接分离的总外泌体作为对照组,另外37个样本则采用上文筛选后的分子标志物组合进行捕获富集,分离获得的PDAC特异性外泌体作为实验组。然后运用ddPCR检测exoDNA的KRAS突变。
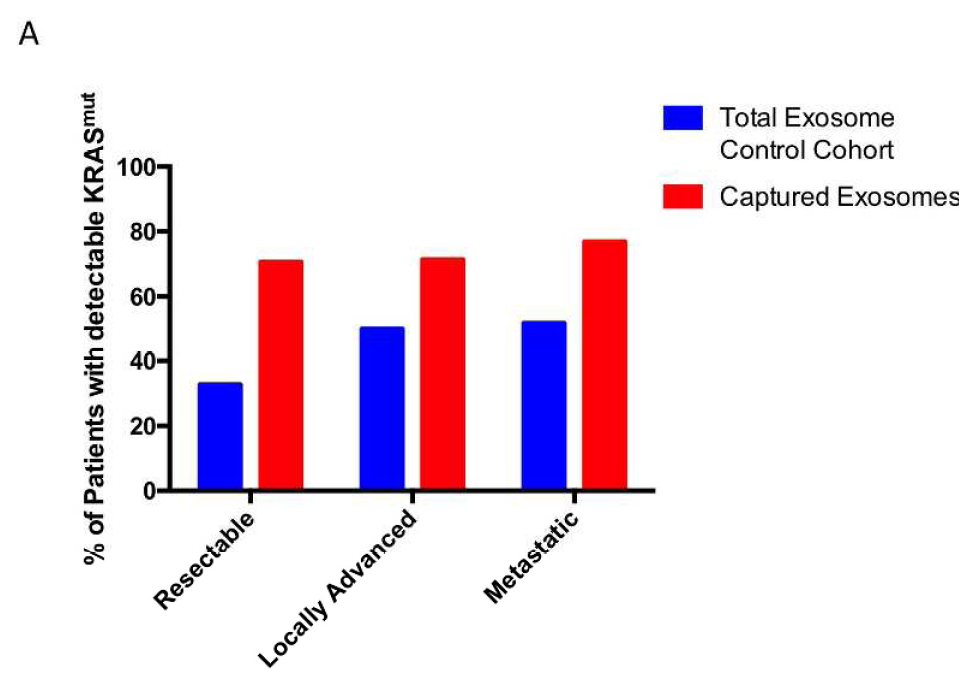
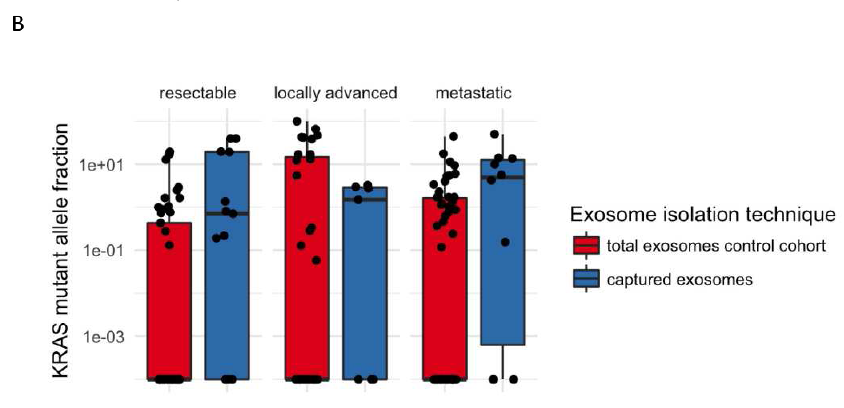
入组患者根据AJCC指南分为可切除、局部进展、转移性这三个分期,对照组中对应的KRAS突变检出率分别为32.7%(17/52)、50%(15/30)和51.8%(28/54);实验组中,突变检出率分别升高至70.6%(12/17)、71.4%(5/7)和76.9%(10/13)。这表明,对于大部分处于治疗期的患者,血液中含有的肿瘤来源外泌体远不及非肿瘤来源的外泌体。此外,可切除和转移性患者中,实验组中检测到的KRAS突变等位基因频率(MAF)也显著高于对照组。
 A:PDAC患者中KRAS基因突变检出率:不同分期患者中,经富集捕获后的外泌体其KRAS突变检出率高于总外泌体检测样本,在可切除患者中检出率显著增高至4.11倍。
A:PDAC患者中KRAS基因突变检出率:不同分期患者中,经富集捕获后的外泌体其KRAS突变检出率高于总外泌体检测样本,在可切除患者中检出率显著增高至4.11倍。
B:KRAS等位基因突变频率(MAF)对比:可切除和转移性患者中,经富集捕获的外泌体中KRAS MAFs较总外泌体显著升高。
跟踪分析一名转移性PDAC患者的基因突变情况,进一步验证经富集后的exoDNA可用于后续复杂的分子分析。该患者接受切除手术后,因携带BRCA2(L583*)体细胞突变入组了一项瑞卡帕布(Rucaparib, PARP1抑制剂)的临床试验,治疗一段时间后疾病进展发生肝转移。
患者治疗期间,抽血直接进行ddPCR检测并未发现KRAS突变,然后尝试先用上述方法富集血液中的exoDNA再行检测发现,KRAS等位基因突变率从0%上升到了3.2%,KRAS突变负荷随着疾病进展而增加。此外,通过富集可以得到足够的DNA含量,用于后续的NGS分析,不仅检测到了患者原发肿瘤灶的已知驱动基因突变,同时检测到了转移灶肝脏组织中的突变,包括KRAS、TP53和BRCA2。值得注意的是,转移组织样本和之后的液体活检样本中均发现了不存在与原发灶组织的BRCA2二次突变,该突变使得因BRCA2 p.L583*突变异常终止的外显子可以拼接转录为完整的mRNA,这极有可能就是PARP抑制剂耐药的机制。 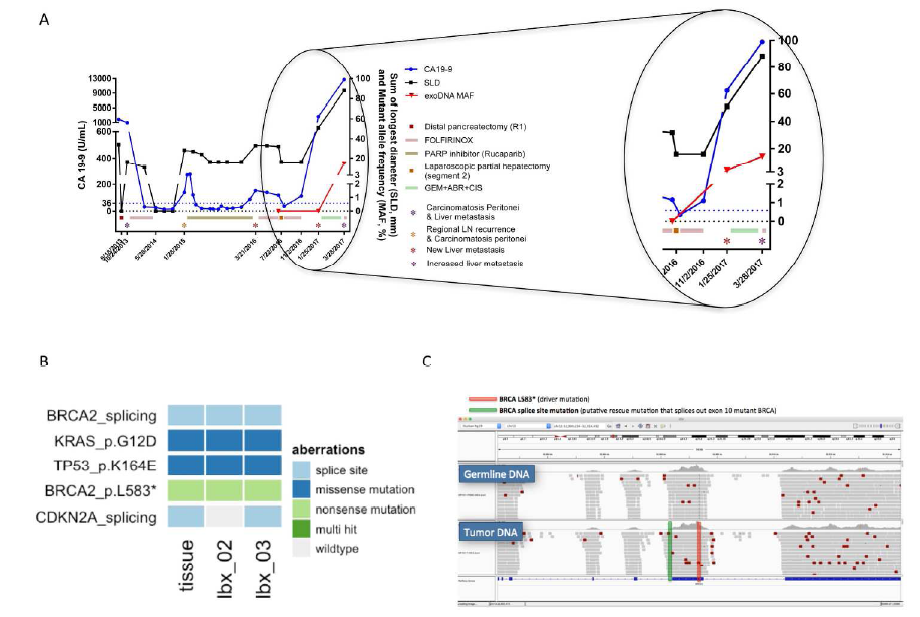 A:经PARP抑制剂治疗后病情进展的患者中,经捕获富集外泌体后可检测到之前无法检测到的KRAS突变,并随着病情进展突变负荷增高。
A:经PARP抑制剂治疗后病情进展的患者中,经捕获富集外泌体后可检测到之前无法检测到的KRAS突变,并随着病情进展突变负荷增高。
B、C:转移组织样本及之后6个月、9个月采集的液体活检样本中均可以检测到BRCA 2的二次突变(BRCA splice site mutation),该突变不存在于原发灶组织中。
结语:
外泌体应用于癌症体液活检,在特异性,稳定性和活性分子含量方面具有明显的优势,外泌体可稳定携带肿瘤细胞来源的miRNA,mRNA,DNA和蛋白质等生物活性分子,相比于循环肿瘤细胞CTC(每1ml血液只含1-10个CTCs),而每毫升血液含有的肿瘤细胞来源的外泌体超过109个。本研究论文从外泌体多标志物联合检测角度出发,筛选鉴定出一组PDAC特异性 “Surfaceome”(CLDN4、EPCAM、CD151、LGALS3BP、HIST2H2BE和HIST2H2BF),通过免疫磁珠法捕获到了PDAC来源的外泌体,进一步检测外泌体中的exoDNA,可有效提高肿瘤驱动基因突变检出率。
.png)