Wnt/β-catenin信号通路参与胚胎形成、组织内稳态、哺乳细胞的增殖和分化等生理过程。正常情况下,在胞浆中β-catenin的丝/苏氨酸位点被糖原合成酶激酶(GSK-3β)磷酸化,接着磷酸化的β-catenin通过泛素蛋白酶体途径降解。如果Wnt信号活化,β-catenin的磷酸化水平则降低,蛋白稳定性增加并在胞浆中积累,随之异位入核,与TCF和淋巴增强子结合因子相互作用,调节靶基因的表达。Wnt/β-catenin信号通路活化和β-catenin的核内积累的情况发生在很多肿瘤类型中,被认为是肿瘤发生发展的重要原因。但是肿瘤中调节β-catenin活化的机制还是有待明确的。
circRNA一般是来源于母系基因的内含子或者外显子,在结构上属于共价闭合的环状RNA。circRNAs具有作为miRNA的sponge,可结合蛋白,可翻译蛋白等功能。circRNAs作为miRNA的sponge,这是一种反式trans调节基因表达的方式,同时也是大多数研究报道的最常见的调控机制,但circRNA还有可能顺式作用方式调节基因的表达。在大多数肿瘤类型,如肝癌、前列腺癌和直肠癌中存在表达失调的circRNAs。但是以顺式作用方式发挥功能的circRNAs是否会影响β-catenin活化和肿瘤发展,也是有待进一步探究。
顺式作用元件(cis-acting element)存在于基因旁侧序列中能影响基因表达的序列。顺式作用元件包括启动子、增强子、调控序列和可诱导元件等,它们的作用是参与基因表达的调控。顺式作用元件本身不编码任何蛋白质,仅仅提供一个作用位点,要与反式作用因子相互作用而起作用。顺式作用元件是指与结构基因串联的特定DNA序列,是转录因子的结合位点,它们通过与转录因子结合而调控基因转录的精确起始和转录效率。顺式作用元件在分子遗传学领域,相对同一染色体或DNA分子而言为“顺式”(cis);对不同染色体或DNA分子而言为“反式”(trans)。
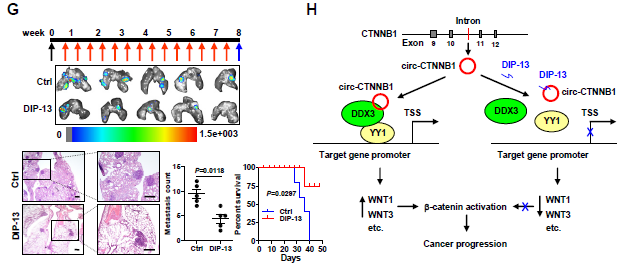
 最近华中科技大学同济医学院附属协和医院的童强松研究团队于Cancer Research上在线发表了题为Cis-acting circ-CTNNB1 promotes β-catenin signaling and cancer progression via DDX3-mediated transactivation of YY1的研究,发现编码β-catenin蛋白的ctnnb1基因来源的circ-CTNNB1结合DDX3,促进其与转录因子YY1的相互作用,从而导致YY1的反式活化,以及促进下游与β-catenin活化和肿瘤发展有关的基因表达。敲低circ-CTNNB1表达或者应用阻断circ-CTNNB1-DDX3相互结合的抑制肽可以明显地抑制致癌基因的表达和肿瘤的发生发展,这首次揭示了circ-CTNNB1的致癌作用以及其可能作为未来肿瘤治疗的有效靶点。
最近华中科技大学同济医学院附属协和医院的童强松研究团队于Cancer Research上在线发表了题为Cis-acting circ-CTNNB1 promotes β-catenin signaling and cancer progression via DDX3-mediated transactivation of YY1的研究,发现编码β-catenin蛋白的ctnnb1基因来源的circ-CTNNB1结合DDX3,促进其与转录因子YY1的相互作用,从而导致YY1的反式活化,以及促进下游与β-catenin活化和肿瘤发展有关的基因表达。敲低circ-CTNNB1表达或者应用阻断circ-CTNNB1-DDX3相互结合的抑制肽可以明显地抑制致癌基因的表达和肿瘤的发生发展,这首次揭示了circ-CTNNB1的致癌作用以及其可能作为未来肿瘤治疗的有效靶点。
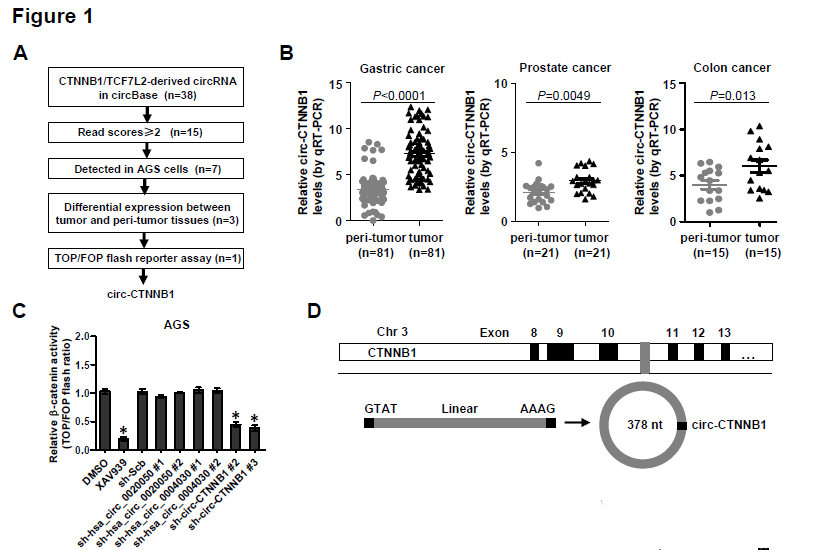
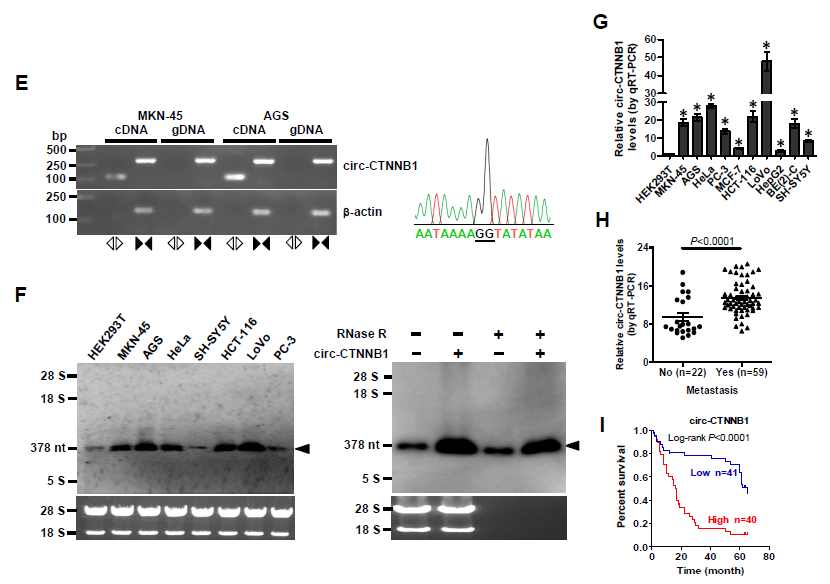
1. 作者通过图1A的方法筛选出CTNNB1基因来源的顺式作用的circRNA——circ-CTNNB1,其在胃癌、前列腺癌和直肠癌中表达上调,敲低circ-CTNNB1表达可以降低胃癌细胞AGS中β-catenin的活性。大小为378nt的circ-CTNNB1实际来源于CTNNB1基因的10号内含子,而且耐受RNase R的消化降解,可在大多数肿瘤中检测到circ-CTNNB1的高表达,在发生转移的肿瘤中circ-CTNNB1的表达水平更高,进一步分析显示circ-CTNNB1的高表达与临床病人的存活率低高度相关。
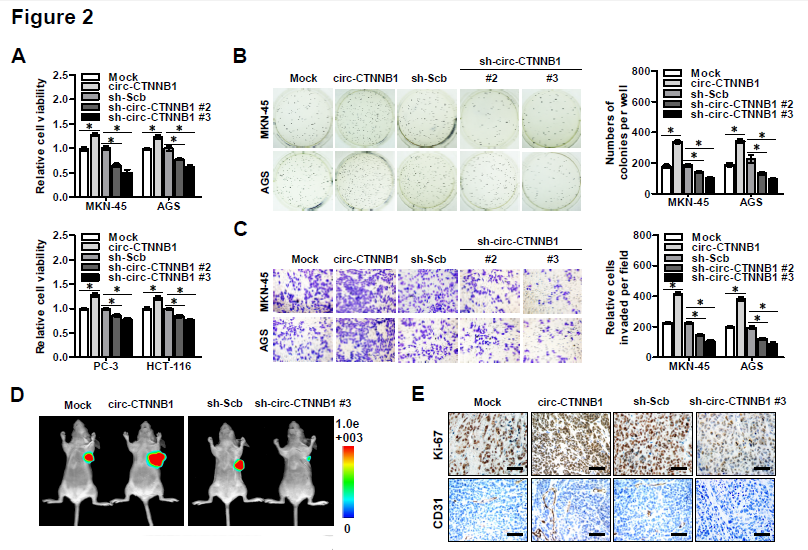
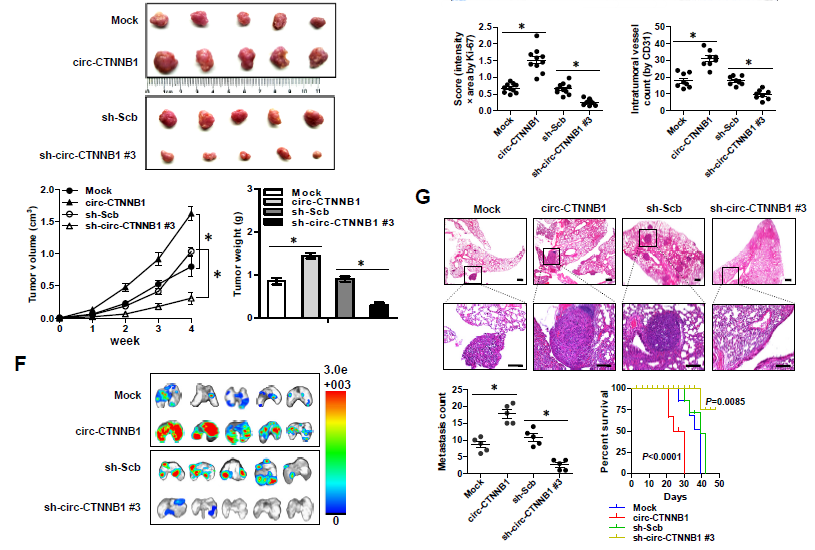
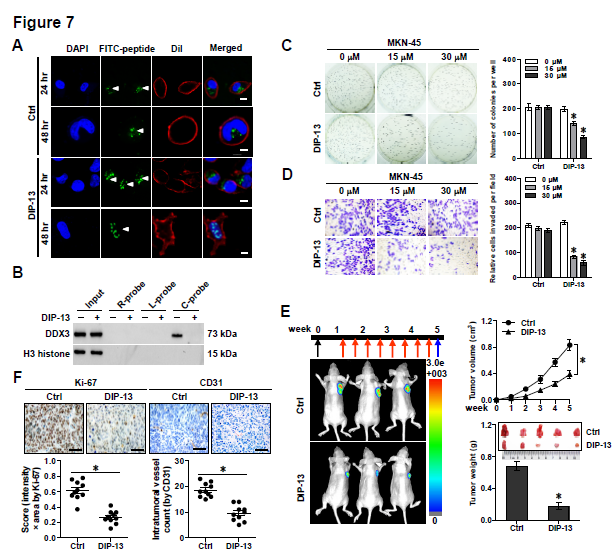
2. circ-CTNNB1的gain or loss of function实验——体外实验验证:接着作者分别在不同类型肿瘤细胞株中过表达或者敲低circ-CTNNB1后,发现其可以分别促进或者抑制细胞存活能力、克隆形成能力和侵袭能力;体内实验验证:过表达或者敲低circ-CTNNB1的癌细胞相应地,在体内成瘤能力增强或者降低,瘤子体积明显增大或者减小,Ki67增殖指数变大或者变小,CD31阳性瘤内微血管形成能力增强或者减弱;在体内尾静脉注射癌细胞后观察肺转移的实验中,过表达或者敲低circ-CTNNB1可以明显促进或者抑制其发生肺转移,导致相应的降低或者提高小鼠存活率的情况。(PS: 本文的circ-CTNNB1过表达载体采用的是吉赛生物的pLCDH-ciR 载体,可转染细胞瞬时表达,也可包装慢病毒构建稳定细胞系,同时表达GFP荧光和 Puromycin抗性基因,可以方便地进行筛选,同时具有过表达效率高、稳定性高和序列环化准确等特点。)
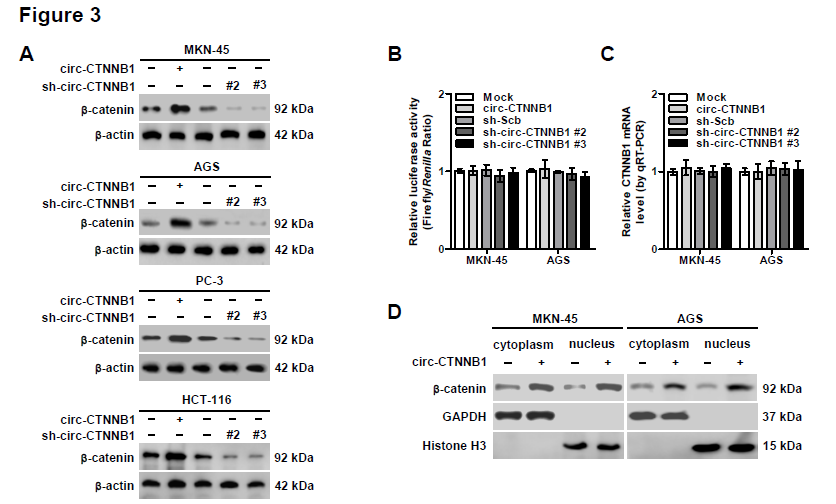
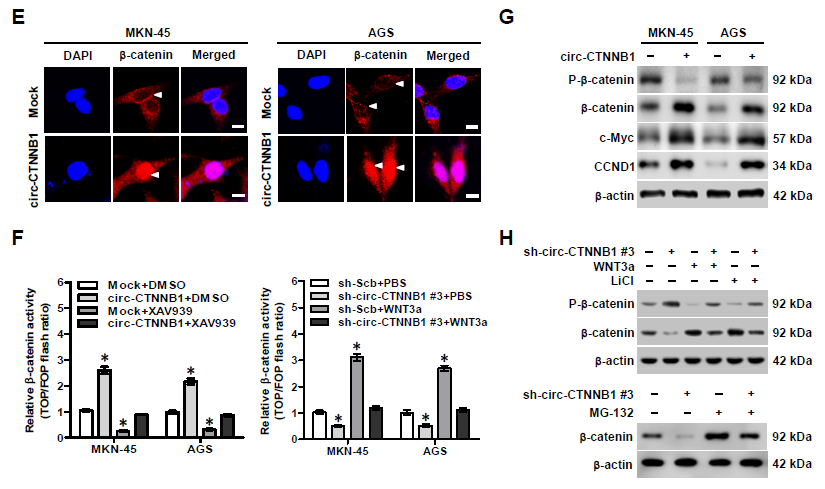
3. 为了解释circ-CTNNB1的致癌机制,作者首先探究了其对母系基因CTNNB1表达的影响。在不同类型肿瘤细胞中,过表达或者敲低circ-CTNNB1表达可以明显上调或者抑制β-catenin的蛋白表达,但并不影响CTNNB1的启动子活性或者转录mRNA水平。而且过表达circ-CTNNB1可以同时上调胞浆和胞核中β-catenin的表达水平;进一步研究发现,过表达或者敲低circ-CTNNB1表达可以明显上调或者抑制β-catenin活性,还可以相应地部分抵消Wnt信号通路抑制剂(XAV939)或者激活剂(WNT3a)的效应。WB实验证明过表达circ-CTNNB1上调β-catenin的蛋白水平主要是因为其降低了β-catenin蛋白的磷酸化水平,抑制了其通过泛素化蛋白酶体途径降解,从而促进其下游靶基因c-Myc和cyclin D1的蛋白表达;另一方面敲低circ-CTNNB1表达上调了β-catenin蛋白的磷酸化水平,该效应可以被WNT3a和GSK-3β抑制剂——LiCl部分抵消。这些结果提示circ-CTNNB1促进β-catenin的表达。
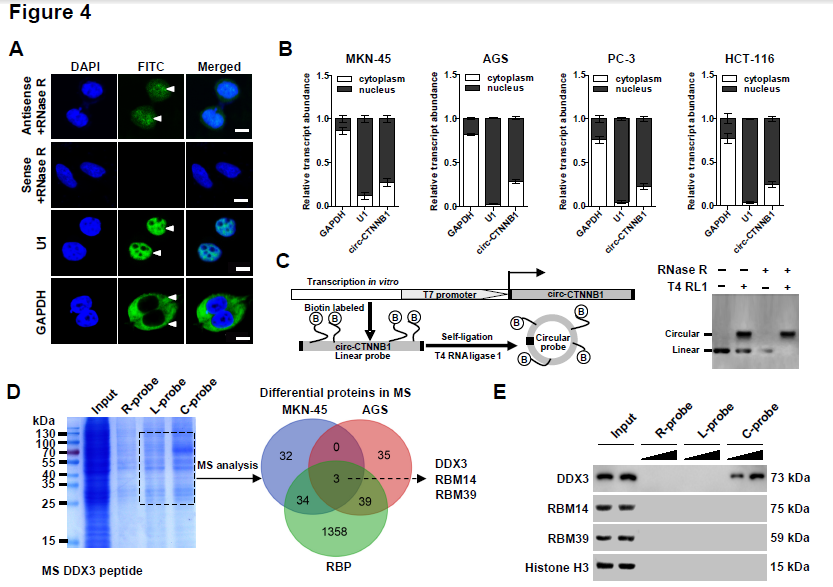
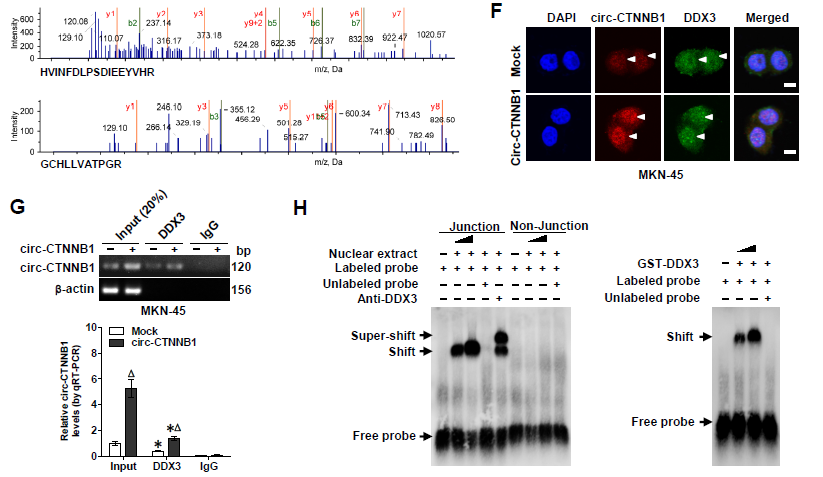
4. circ-CTNNB1发挥功能需要借助什么蛋白partners?RNA-FISH和亚细胞组份分析证明circ-CTNNB1主要定位于胞核中,借助特异性biotin标记的circ-CTNNB1进行RNA pull-down蛋白复合物后再质谱分析蛋白的实验,结合两种细胞株的结果和RBPs数据库筛选出了三种RBPs蛋白,体外再次利用biotin标记的RNA pull-down实验进行二次验证,发现只有DDX3可以与circ-CTNNB1结合,并呈现剂量依赖性;同样地,RNA-FISH、RIP和RNA-EMSA实验均证明了circ-CTNNB1与DDX3相互结合。
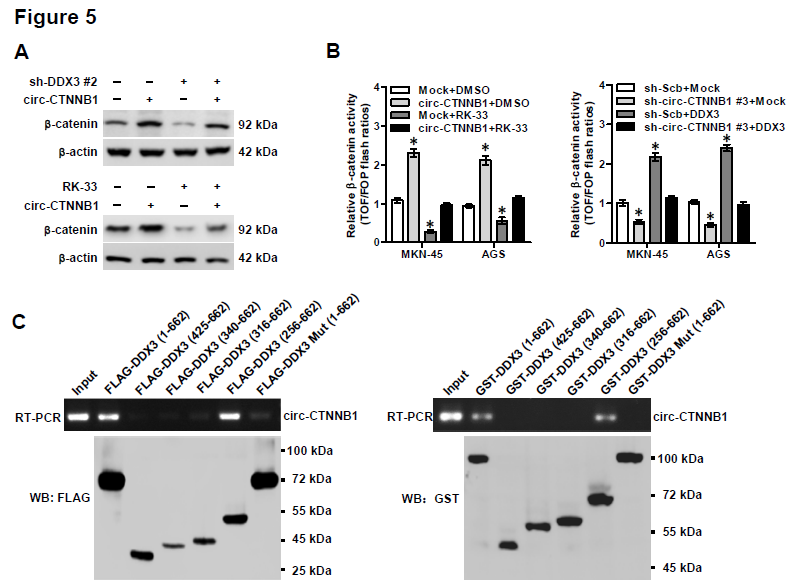
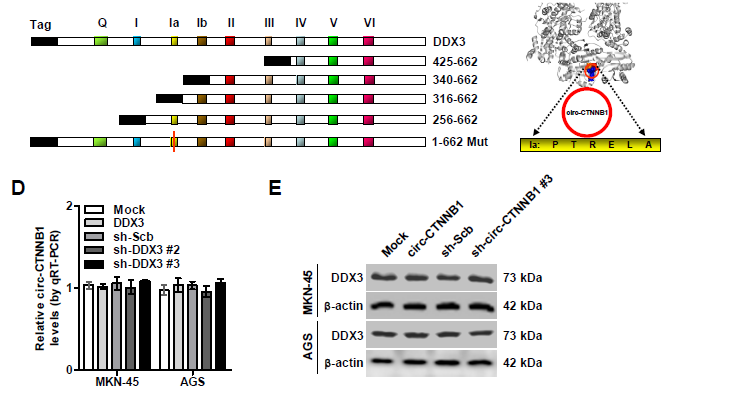
5. circ-CTNNB1与DDX3相互结合是否可以调控β-catenin的表达和活性?过表达circ-CTNNB1促进β-catenin蛋白表达的效应,会被DDX3敲低或者DDX3抑制剂RK-33部分抵消。同样地,过表达或者敲低circ-CTNNB1表达促进或者抑制β-catenin活性的效应,也会被RK-33处理或者DDX3过表达所部分抵消。构建不同截短体的DDX3进行体外结合试验,证明了DDX3蛋白的256-315氨基酸(主要是Ia区域的274-279aa)对于circ-CTNNB1的结合是至关重要的。有趣的是,circ-CTNNB1与DDX3两者的表达并不会相互影响。
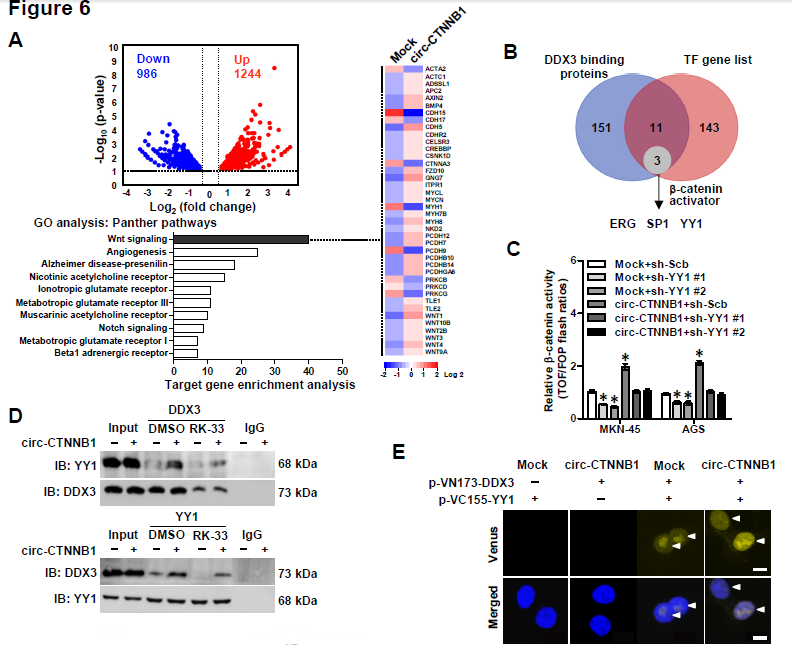
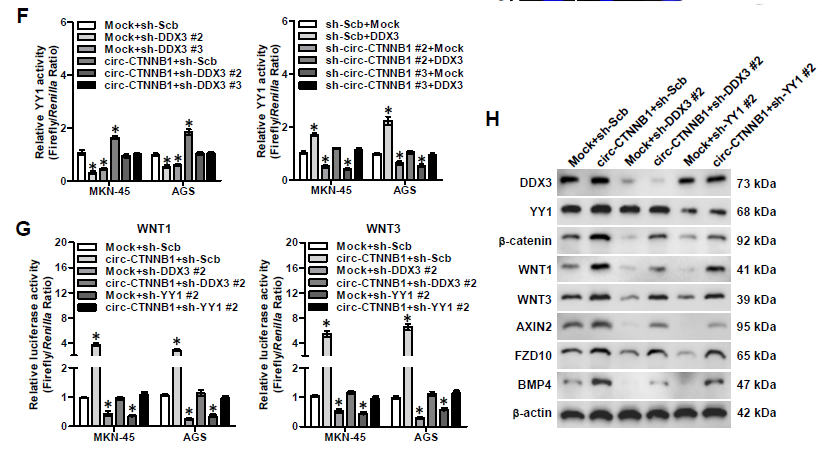
6. 下一步作者继续深入探究circ-CTNNB1的下游靶基因,通过circ-CTNNB1过表达后RNA-seq分析相关基因的变化,发现1244种基因出现上调,986种基因出现下调;GO分析发现差异表达的基因大部分与Wnt信号通路相关,包括WNT1, WNT3,AXIN2, FZD10和BMP4这五种基因。通过图6B的方法筛选出共同调控这些与Wnt信号通路基因的转录因子,主要是ERG、SP1和YY1。作者发现只有敲低YY1的表达才可以抑制circ-CTNNB1诱导上调的β-catenin表达。Co-IP和BiFC实验均证明了DDX3与YY1相互结合,而且circ-CTNNB1过表达促进,而RK-33处理抑制两者的相互结合。双荧光素酶报告基因实验证明了circ-CTNNB1和DDX3表达对于促进YY1转录活性的重要性,也证明了circ-CTNNB1、DDX3和YY1表达对于促进Wnt信号通路相关的WNT1、WNT2、AXIN2, FZD10和BMP4基因的表达的重要性。
7. 靶向circ-CTNNB1-DDX3结合对肿瘤治疗效应的影响?circ-CTNNB1表达敲低的细胞在小鼠体内成瘤和转移的能力会明显降低,小鼠存活率也都得到明显提高,说明靶向。circ-CTNNB1可以获得很好的抗肿瘤效应。接着作者针对circ-CTNNB1-DDX3结合的重要区域研发了一种细胞通透性的靶向DDX3的长度约为13aa的抑制性肽(DIP-13),通过IP和荧光素酶报告基因实验证明其可以体外明显抑制circ-CTNNB1-DDX3相互结合,同时体外应用抑制肿瘤的生长、增殖和侵袭能力(C,D)。通过分析成瘤体积、肿瘤肿瘤、Ki67增殖指数、CD31阳性的微血管形成和下游基因表达情况等指标,动物体内成瘤实验发现应用该DIP-13抑制肽可以明显抑制小鼠的体内成瘤能力、抑制肿瘤的肺转移情况和提高小鼠存活率。
参考文献
1. Yang F,et al. Cis-acting circ-CTNNB1 promotes β-catenin signaling and cancer progression via DDX3-mediated transactivation of YY1. Cancer Res. 2018 Dec 18. pii: canres.1559.2018. doi: 10.1158/0008-5472.CAN-18-1559.
.png)