Cell Research丨明星分子PD-L1也存在外泌体上?也有促肿瘤效应?

来自德克萨斯州休斯顿德克萨斯大学MD安德森癌症中心的Mien-Chie Hung教授团队的研究人员,发现肿瘤微环境中肿瘤分泌的PD-L1阳性的外泌体可以抑制T细胞对乳腺癌细胞的杀伤效应,促进肿瘤的生长的现象,提出了阻断肿瘤分泌PD-L1阳性的外泌体对于抗肿瘤免疫的意义,提示临床上联合应用外泌体分泌的抑制剂和抗PD-L1抗体治疗肿瘤,有助于提高抗肿瘤免疫反应和清除肿瘤。
1. 提出问题
肿瘤与微环境的相互作用在肿瘤的发展、转移和药物耐受中其重要作用,越来越多的研究也提示了,肿瘤来源的外泌体可以通过从供体细胞转移一些分子(如miRNAs、mRNA和蛋白质)到受体细胞,从而调节和重编程肿瘤微环境。PD-L1是经典的免疫表面分子,可以通过结合PD-1抑制抗T细胞的肿瘤免疫,并有效地保护肿瘤不被免疫清除。已有大量文献报道,外泌体包含很多膜蛋白(如EGFR和MET蛋白),可以促进肿瘤的转移。而PD-L1作为一种膜结合蛋白,肿瘤来源的外泌体是否含有PD-L1蛋白,而这种蛋白在肿瘤发展过程中起到什么作用?
2. 肿瘤来源外泌体的鉴定及其表面分子的定位
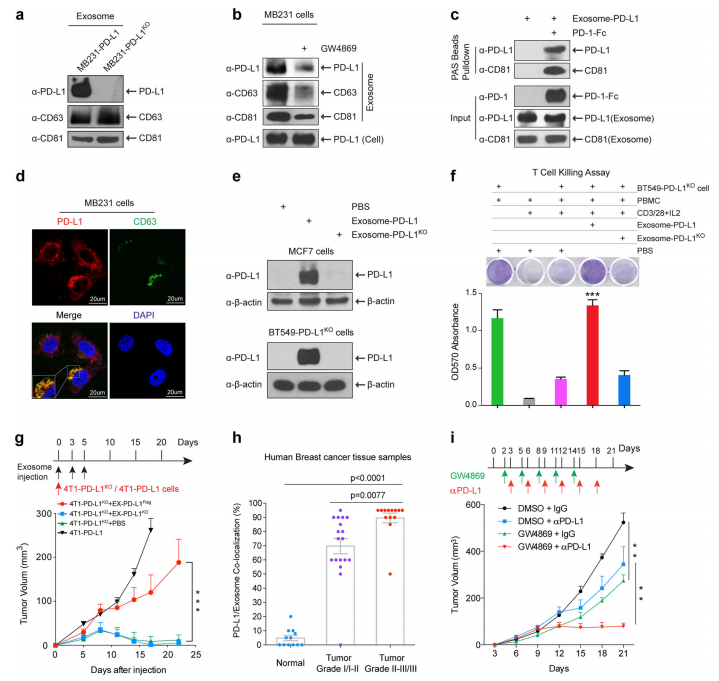
作者对人乳腺癌细胞(MDA-MB-231)和小鼠乳腺癌细胞系(4T1)进行PD-L1的分别过表达和敲除后,差速超速离心分离细胞培养上清中的富含PD-L1的外泌体 (exosome-PD-L1)和无PD-L1的外泌体 (exosome-PD-L1KO),进行了透射电镜鉴定形态和WB鉴定外泌体marker蛋白的表达情况(a)。给予外泌体分泌抑制剂GW4869处理肿瘤细胞后,其分泌外泌体的marker蛋白和PD-L1蛋白的表达都下调,而肿瘤细胞裂解物中的PD-L1总蛋白无明显变化(b)。另外体外结合实验发现,PD-1-Fc蛋白可以同时捕获到exosome-PD-L1中的PD-L1和CD81蛋白,提示外泌体表面含有PD-L1蛋白(c)。IF和IHC染色231细胞,显示PD-L1和CD63蛋白在细胞内MVBs小体的共定位(d)。
MCF-7细胞和BT549-PD-L1KO都是PD-L1 mRNA和蛋白都低表达的细胞,给予exosome-PD-L1处理这两种细胞后,胞内PD-L1蛋白水平明显升高,说明PD-L1蛋白转移到细胞内(e)。作者还构建了231-PD-L1EGFP转基因细胞分泌的带有绿色荧光的PD-L1EGFP外泌体,confocal成像证明其可以转移到BT549细胞中。体内回输4T1-PDL1KO细胞和EX-PD-L1Flag外泌体到BALB/c小鼠乳腺的脂肪垫下,5天后IF染色肿瘤组织发现只有EX-PD-L1Flag,而不是EX-PD-L1KO,使得肿瘤携带PD-L1Flag阳性。而且流式检测发现,外泌体可以传递PD-L1蛋白到靶细胞的膜表面,并结合PD-1分子。PBMC经过CD3/28抗体和IL-2活化增殖后,才可以杀伤BT549-PD-L1KO肿瘤细胞,如果同时给予不同剂量的EX-PD-L1Flag,而不是EX-PD-L1KO处理后,T细胞的ERK磷酸化和NF-kB活化被抑制,其杀伤BT549-PD-L1KO肿瘤细胞的效应也被抑制,并呈现剂量依赖性(f)。外泌体上的PD-L1分子可以从PD-L1阳性的乳腺癌细胞转移到PD-L1阴性的乳腺癌细胞中,抑制T细胞的活化和杀伤效应。作者还证明了exosome-PD-L1在体外可以转移PD-L1分子到THP-1细胞、人抗原递呈细胞(人巨噬细胞和树突状细胞)。人病理切片的IF实验证明EX-PD-L1Flag,而不是EX-PD-L1KO转移PD-L1分子到肿瘤组织中的巨噬细胞(不包括树突状细胞)中。
4. 外泌体PD-L1蛋白的体内功能验证
PD-L1缺陷的4T1-PD-L1KO细胞在体内的成瘤效果是非常差的,但同时给予EX-PDL1Flag,而不是EX-PD-L1KO一起回输后,4T1-PD-L1KO肿瘤细胞的成瘤效果就恢复正常(g), 并呈现外泌体剂量依赖性。4T1-PD-L1KO肿瘤细胞和EX-PDL1Flag一起回输后,肿瘤组织汇总granzyme B表达明显减少,提示肿瘤微环境中细胞毒性T细胞的活性降低。
人肿瘤组织IHC染色后,同样发现PD-L1分子和外泌体marker CD63在MVBs的共定位。对人乳腺癌组织微芯片分析,显示高水平的PD-L1分子和CD63分子共定位与疾病进展程度的分期正相关(h)。给予外泌体分泌抑制剂GW4869处理后,虽然不抑制4T1细胞的体外生长,但是抑制4T1肿瘤细胞在BALB/c小鼠体内生长,提示GW4869通过调节抗肿瘤免疫来抑制肿瘤的体内生长。而且GW4869联合anti-PD-L1治疗,抑制4T1肿瘤细胞在BALB/c小鼠体内生长的效果更加明显(i)。基因敲除抑制外泌体分泌:作者构建了Tet-on 诱导Rab27a 敲低的4T1细胞系,给予阿霉素处理细胞后外泌体的分泌明显减少,该细胞在体内的生长也受到抑制。该细胞体内成瘤的同时给予anti-PD-L1治疗,明显增强了PD-L1抗体抑制肿瘤的效应(i)。

参考文献
1. Yang Y, et al.. Exosomal PD-L1 harbors active defense function to suppress T cell killing of breast cancer cells and promote tumor growth[J]. Cell Research. 2018. DOI: 10.1038/s41422-018-0060-4.
.png)