6月11日,Cancer Letters杂志在线发表了杨柏华教授的最新研究论文,介绍发现circCcnb1参与调控Ccnb1/Cdk1复合物,抑制肿瘤侵袭和发展[1]。广州医科大学附属第二医院的Dong Jun是本文的共同通讯作者。

circCcnb1与Ccnb1和Cdk1的相互作用发现与鉴定
杨教授团队去年就曾经在2018年发表过关于circCcnb1的文章[2],(推荐:乳腺癌中circ-Ccnb1抵消p53突变的效应)。在此研究基础上,在本文的早期探索过程中作者提出circCcnb1可能会通过结合细胞周期相关蛋白而调控细胞增殖,因此作者用常见细胞周期相关的周期蛋白和CDK激酶的抗体进行免疫沉淀,然后QPCR分析相互作用的circRNA分子(RIP实验)。结果表明,HTB-126细胞中Ccnb1和Cdk1可以显著富集circCcnb1,但对Ccnb1的mRNA没有富集作用,于是作者就把研究的重点放在circCcnb1与Ccnb1/Cdk1复合物的相互作用上。
RNA Pull-down实验进一步证明了circCcnb1与Ccnb1和Cdk1的相互作用,干扰circCcnb1可显著减少被Ccnb1或Cdk1的抗体捕获的效率。信息学预测表明circCcnb1在两个不同的位点分别与Ccnb1和Cdk1相互作用。这一结果暗示circCcnb1可能在Ccnb1与Cdk1的相互作用中起到类似脚手架的作用。

图1 circCcnb1可与Ccnb1和Cdk1的相互作用 ([1])
进一步,CoIP实验条件下增加RNase A消化处理,如果circCcnb1在Ccnb1与Cdk1的相互作用中起到非常重要的桥接作用,那么在RNase A消化处理后,Ccnb1与Cdk1分别被CoIP捕获的效率势必显著减少。基于预测分析得到circCcnb1分别与Ccnb1或Cdk1相互作用的位置信息,分别构建突变体,然后转染细胞,Pull-down实验验证Ccnb1与Cdk1相互作用的情况,结果表明这些突变体可以显著降低Pull-down捕获对应蛋白的效率。
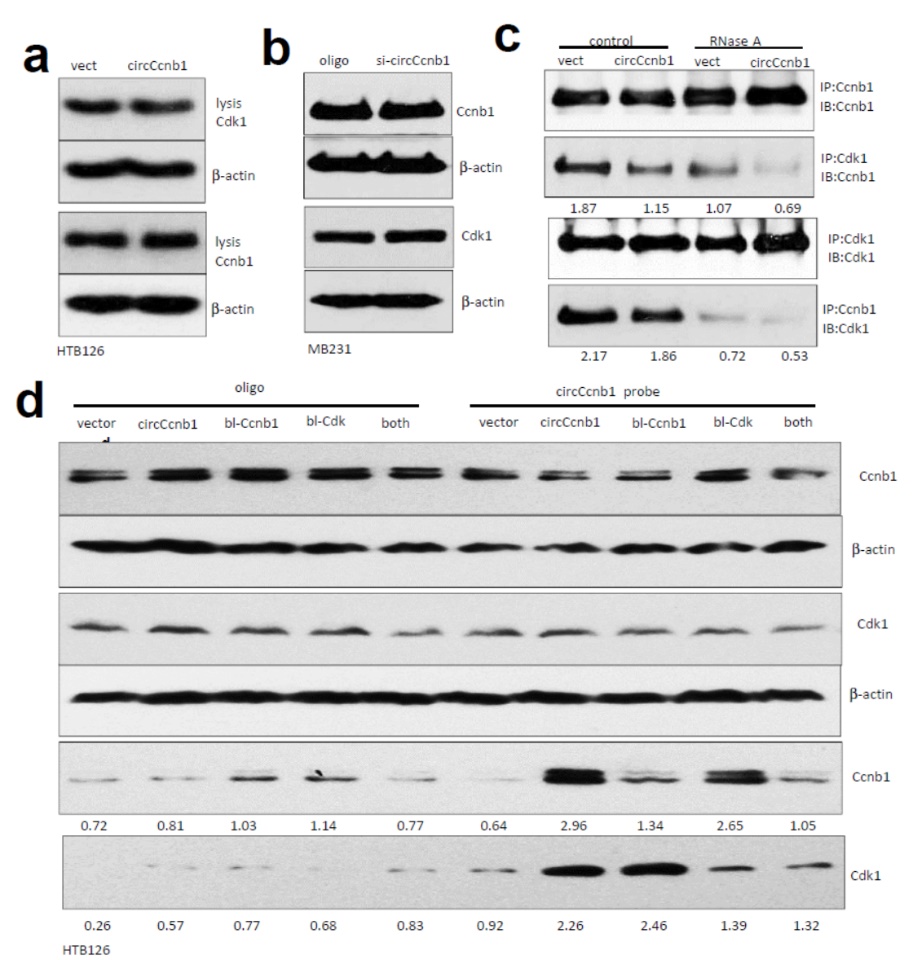
图2 circCcnb1调控Ccnb1与Cdk1的相互作用 ([1])
circCcnb1调控Ccnb1/Cdk1的入核
Ccnb1与Cdk1通常定位于核中,而大部分circRNA更倾向于定位于胞质中,那么circCcnb1与Ccnb1/Cdk1是如何相互作用的?它们的定位是怎样的?为弄清楚这些问题,作者分离了胞浆与核组分进行QPCR检测,结果表明circCcnb1在核中含量更高。 过表达circCcnb1不能影响Ccnb1与Cdk1的蛋白表达水平,但显著降低这两个蛋白定位到细胞核中的比例。交联后RIP实验表明Ccnb1或Cdk1抗体均能有效捕获circCcnb1,对线性Ccnb1的mRNA没有富集作用。过表达circCcnb1促进Ccnb1或Cdk1抗体捕获捕获circCcnb1的数量,干扰circCcnb1则降低被捕获效率,并且促进Ccnb1与Cdk1的入核。
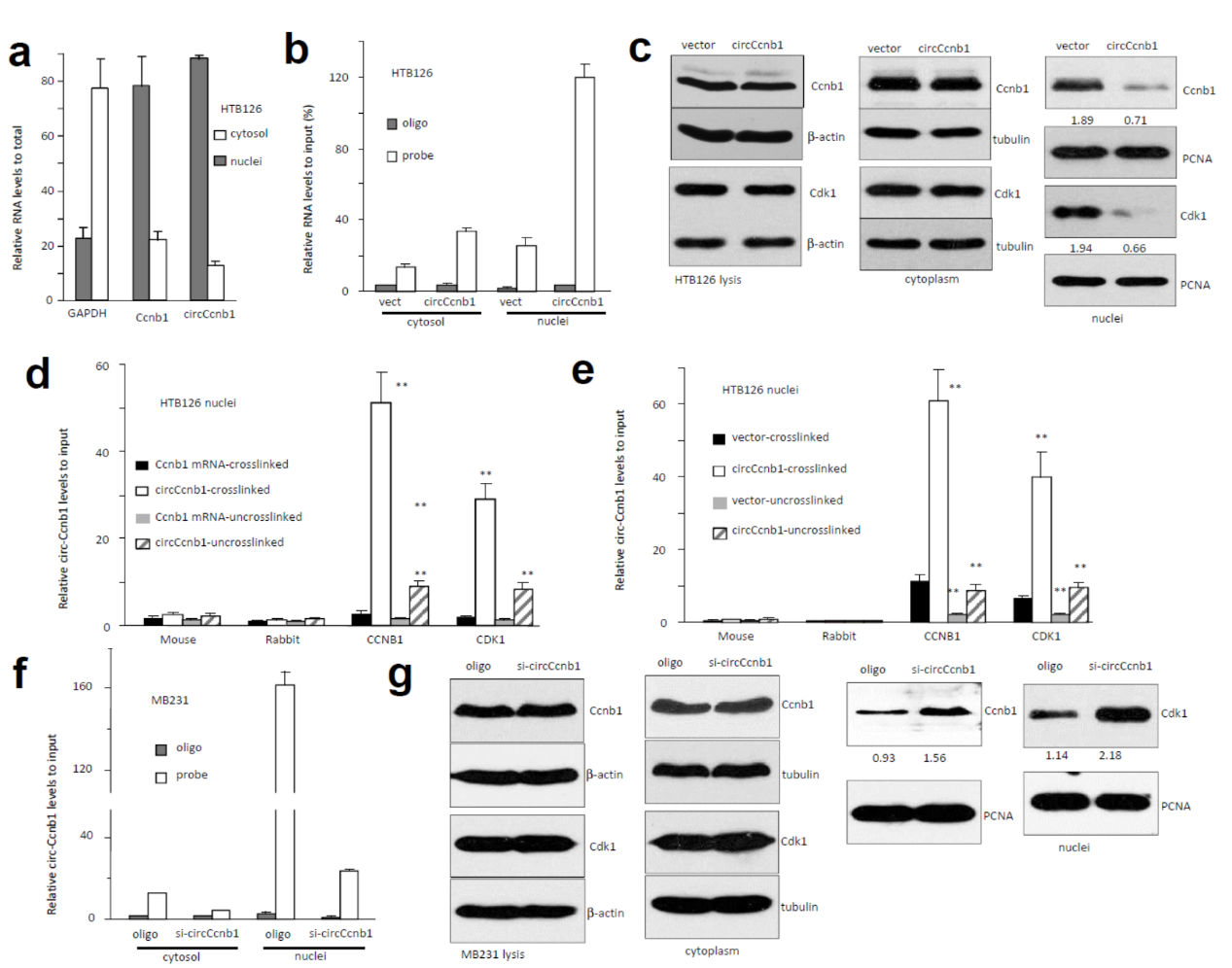
图3 circCcnb1调控Ccnb1与Cdk1的入核 ([1])
过表达circCcnb1有助于增加被circCcnb1探针捕获的Ccnb1和Cdk1蛋白。干扰circCcnb1则降低Ccnb1或Cdk1相互被捕获的效率。根据预测得到的circCcnb1与Ccnb1和Cdk1相互作用的核酸片段信息,设计合成针对两个位置的封闭探针分子。单独转染针对Ccnb1或Cdk1结合位点的探针分子不影响Ccnb1和Cdk1的入核,但共转染两种探针则促进Ccnb1和Cdk1的入核。在HTB126细胞中分别过表达circCcnb1或转染上述探针分子,做交联处理后看细胞核组分中被非特异探针或circCcnb1探针捕获对应蛋白的情况。结果表明这些封闭探针分子可降低对应蛋白被捕获的效率。
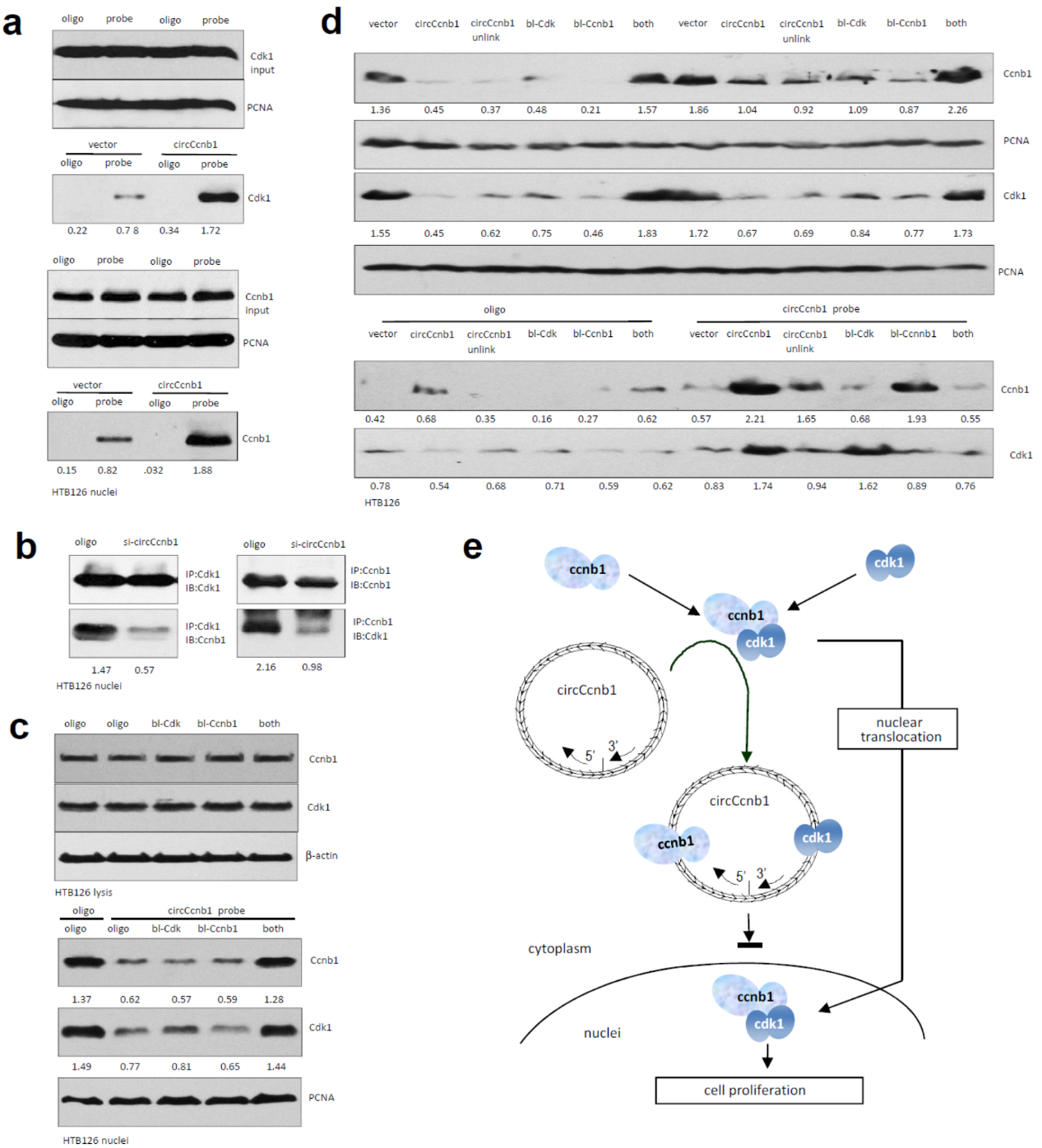
图4 circCcnb1抑制Ccnb1和Cdk1蛋白入核 ([1])
circCcnb1抑制侵袭和增殖
过表达circCcnb1抑制划痕愈合,干扰circCcnb1则促进划痕愈合。单独转染上述的两种封闭探针的一种可抑制划痕愈合,共转染两种探针后不再抑制划痕愈合。细胞侵袭实验也得到了类似的结果,过表达circCcnb1抑制侵袭,干扰circCcnb1则促进侵袭,。单独转染两种封闭探针的一种也可显著抑制细胞侵袭,但共转染两种探针则不能抑制细胞侵袭。
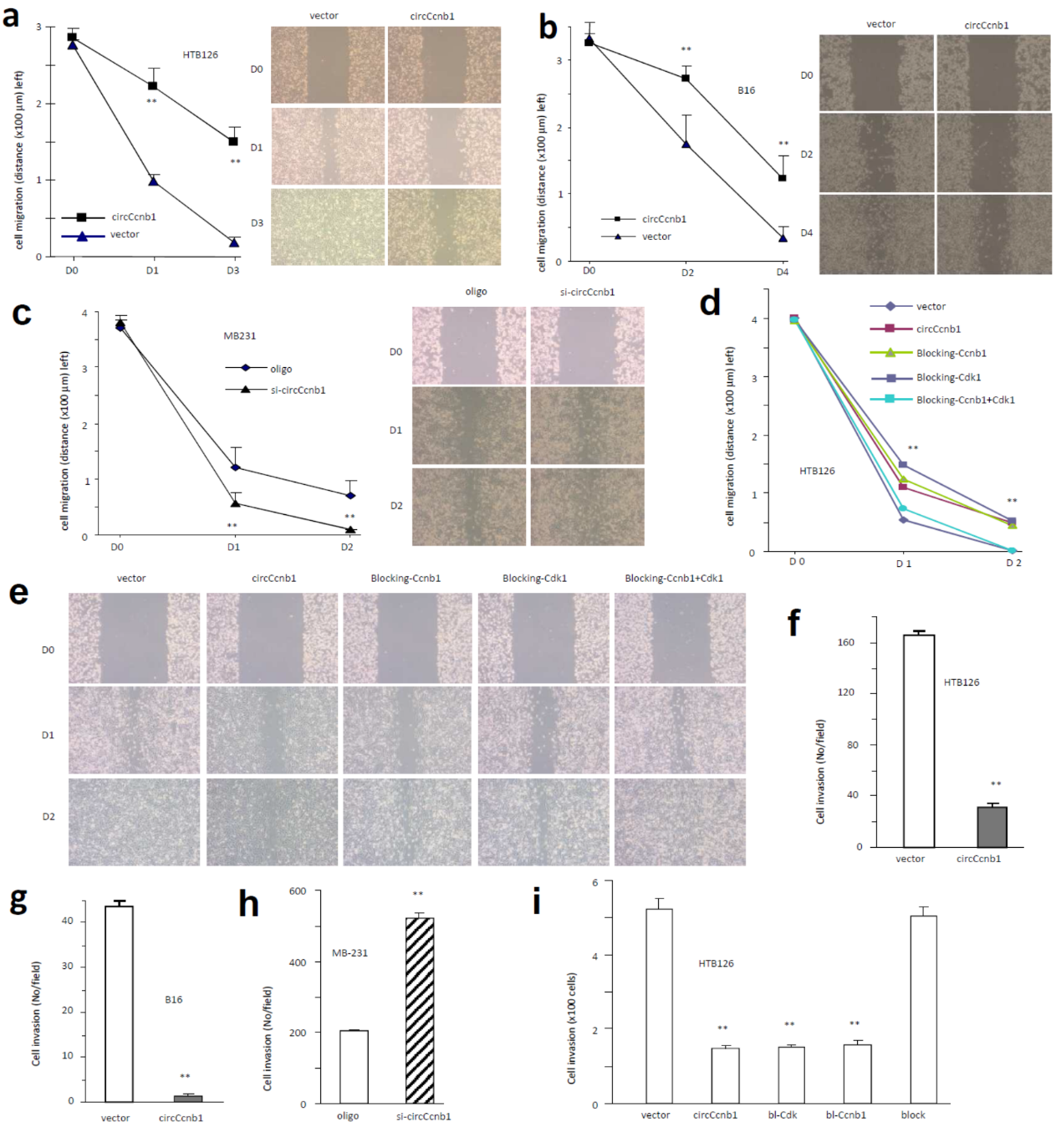
图5 circCcnb1通过与Ccnb1和Cdk1相互作用抑制细胞侵袭 ([1])
增殖速率分析表明过表达circCcnb1或单独转染其中一种封闭探针均能抑制细胞增殖,但共转染两种封闭探针后这一抑制作用就消失了。

图6 circCcnb1通过与Ccnb1和Cdk1相互作用抑制细胞增殖 ([1])
circCcnb1抑制体内肿瘤增殖速度和侵袭比例
体内成瘤实验表明过表达circCcnb1可显著延长小鼠的生存期。过表达circCcnb1不影响Ccnb1和Cdk1总蛋白量, 但可减少它们定位于细胞核内的比例。两种封闭探针单独给小鼠注射并不能显著影响生存期,但同时注射却可以显著加速小鼠的死亡。单独注射一种封闭探针不影响Ccnb1和Cdk1总蛋白量, 也不定位于细胞核内的比例,但两种探针共注射则促进Ccnb1和Cdk1定位核内的比例。

图7 circCcnb1抑制肿瘤发展 ([1])
参考文献
1. Fang, L., et al., The circular RNA circ-Ccnb1 dissociates Ccnb1/Cdk1 complex suppressing cell invasion and tumorigenesis. Cancer Lett, 2019.
2. Fang, L., et al., Enhanced breast cancer progression by mutant p53 is inhibited by the circular RNA circ-Ccnb1. Cell Death Differ, 2018. 25(12): p. 2195-2208.
.png)