4月25日,Cell杂志发表了一篇circRNA的重磅文章,介绍发现circRNA参与细胞抗病毒免疫效应机制,该机制在系统性红斑狼疮等自身免疫疾病中发挥特殊作用。文章的通讯作者是陈玲玲教授,杨力教授和上海交通大学医学院附属仁济医院沈南教授[1]。
文中作者发现许多circRNA倾向于形成16-26bp不等的小颈环结构,该结构可结合并抑制双链RNA依赖性蛋白激酶R(double-stranded RNA-activated protein kinase,PKR),当细胞受到poly(I:C)刺激处理或病毒感染时,核酸内切酶RNase L激活并降解circRNA分子,PKR被释放并激活下游抗病毒效应机制。系统性红斑狼疮(Systematic lupus erythematosus,SLE)患者外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中circRNA总体降低,PKR活性紊乱,但人为过表达circRNA有助于降低SLE患者PBMC中PKR的活性,将来或许有助于SLE等自身免疫疾病的治疗[1]。下面就让我们一起学习一下作者如何一步步发现这一机制的:
poly(I:C)刺激或病毒感染可促进circRNA的降解
circRNA的降解机制一直未能得到很好的解析,作者早期也是希望能通过不同的刺激条件探索与circRNA降解有关的条件和通路,于是作者分析了不同刺激条件对circRNA丰度的影响情况。作者挑选了五种广泛表达且丰度较高的circRNA分子(见图1),分析了它们在Hela细胞中分别受不同刺激条件后的表达丰度变化情况,选择的刺激条件包括:poly(I:C)刺激(常用与模拟病毒感染刺激),HT-DNA(herring testes DNA,模拟双链DNA刺激),ISD(IFN-stimulating DNA,模拟双链DNA刺激),LPS(细菌脂多糖,模拟细菌感染),Tg(thapsigargin,模拟细菌感染),IFNγ(炎症性细胞因子),α-amanitin(RNA聚合酶II抑制剂,抑制转录)。其中poly(I:C)刺激可显著降低circRNA的丰度,其他条件均变化不明显。α-amanitin是RNA聚合酶II的抑制剂,在该实验的条件下没有显著降低几个被挑选的circRNA的丰度,但叠加处理poly(I:C)则可显著降低这些circRNA的丰度,说明poly(I:C)处理是促进circRNA的降解的。poly(I:C)处理促进circRNA降解的现象也在其他细胞中得到了验证,包括PA1, THP1和 Jurkat细胞。
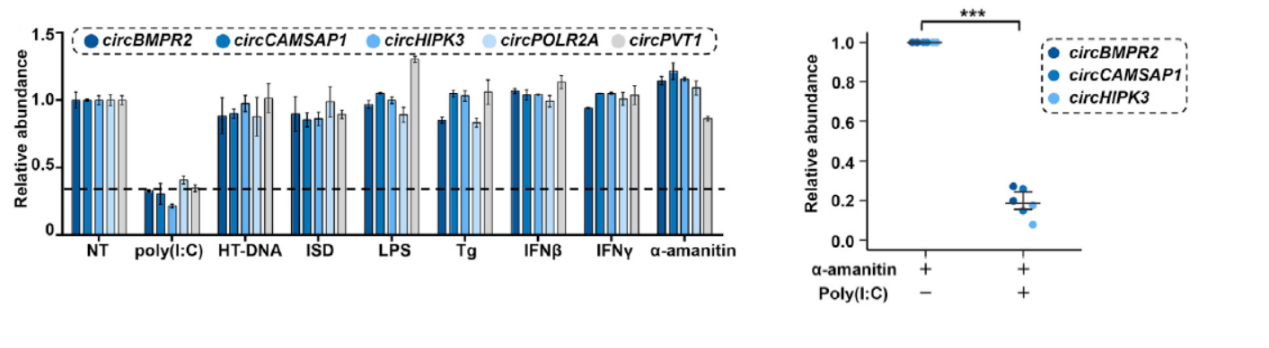
图1 不同刺激条件对circRNA稳定性的影响 (图片引自[1],排列有调整)
poly(I:C)对circRNA的影响是广泛的,不是只对少数几个circRNA分子发挥作用的,并且这一降解作用也能够通过EMCV病毒感染实现。

图2 poly(I:C)刺激对circRNA稳定性的影响是广泛的 ([1])
RNase L是poly(I:C)刺激或病毒感染后介导circRNA降解的酶
已知病毒感染或poly(I:C)处理后能激活RNase L(一种广泛存在的RNA内切酶,二聚化后可降解RNA),为分析是否是RNase L介道了poly(I:C)处理后的circRNA降解过程,作者在Hela细胞中构建了RNase L敲除细胞系,结果表明敲除RNase L后poly(I:C)处理不能显著促进circRNA的降解,巧除细胞株中回补野生型或突变型RNase L也验证了对应的现象。作者也构建了RNase L干扰的模型,也能佐证了相关的现象。poly(I:C)处理或EMCV感染后RNase L不仅能降解circRNA,也能降解线性的mRNA,但mRNA的降解比例不高,仅有10-30%,circRNA的降解比例则高达80-90%。
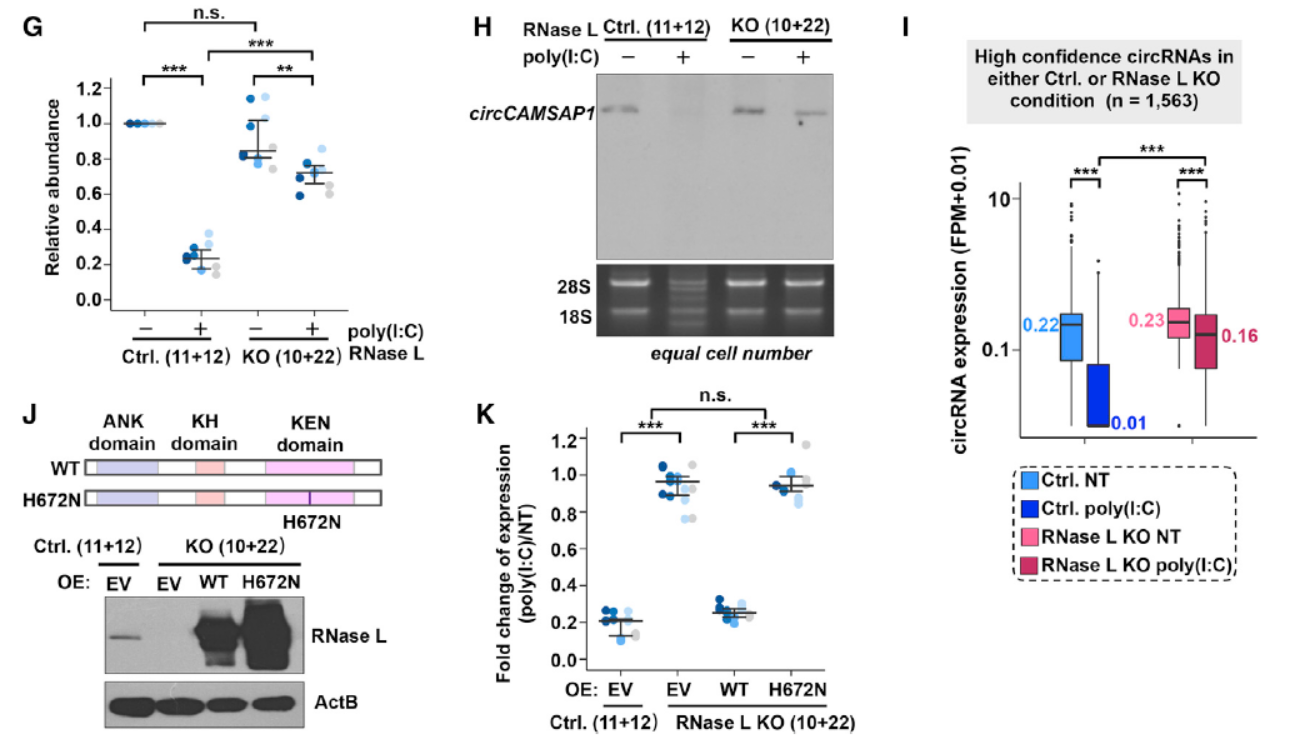
图3 RNase L是poly(I:C)刺激后circRNA降解的酶 ([1])
RNase L是poly(I:C)刺激或病毒感染后介导circRNA降解的酶
细胞中存在多种识别外源致病性双链RNA分子的受体分子,大致可分为两大类,一类是通过识别不同生化特征的外源RNA分子并激活基因转录和细胞因子的表达诱导免疫反应,这一类的dsRNA受体包括TLR3,RIG-I和MDA5。另一类分子本身就具有抵抗RNA病毒活性的受体分子,包括PKR,NF90,ADAR1-p150和OAS1,它们识别不同长度的外源RNA分子,并进一步通过抑制翻译,促进降解及引入修饰等途径实现抵抗外源RNA的效应。为探索上述现象的分子机制,作者构建了体外实验体系,分别过表达纯化已知的外源RNA受体分子和circPOLR2A及对应序列的线性RNA分子,IP后Northern Blot检测相关蛋白分子对circPOLR2A及对应序列的线性RNA的结合情况。结果表明PKR和NF90可显著的结合circPOLR2A。另一种分子circCAMSAP1也验证了这一结果。
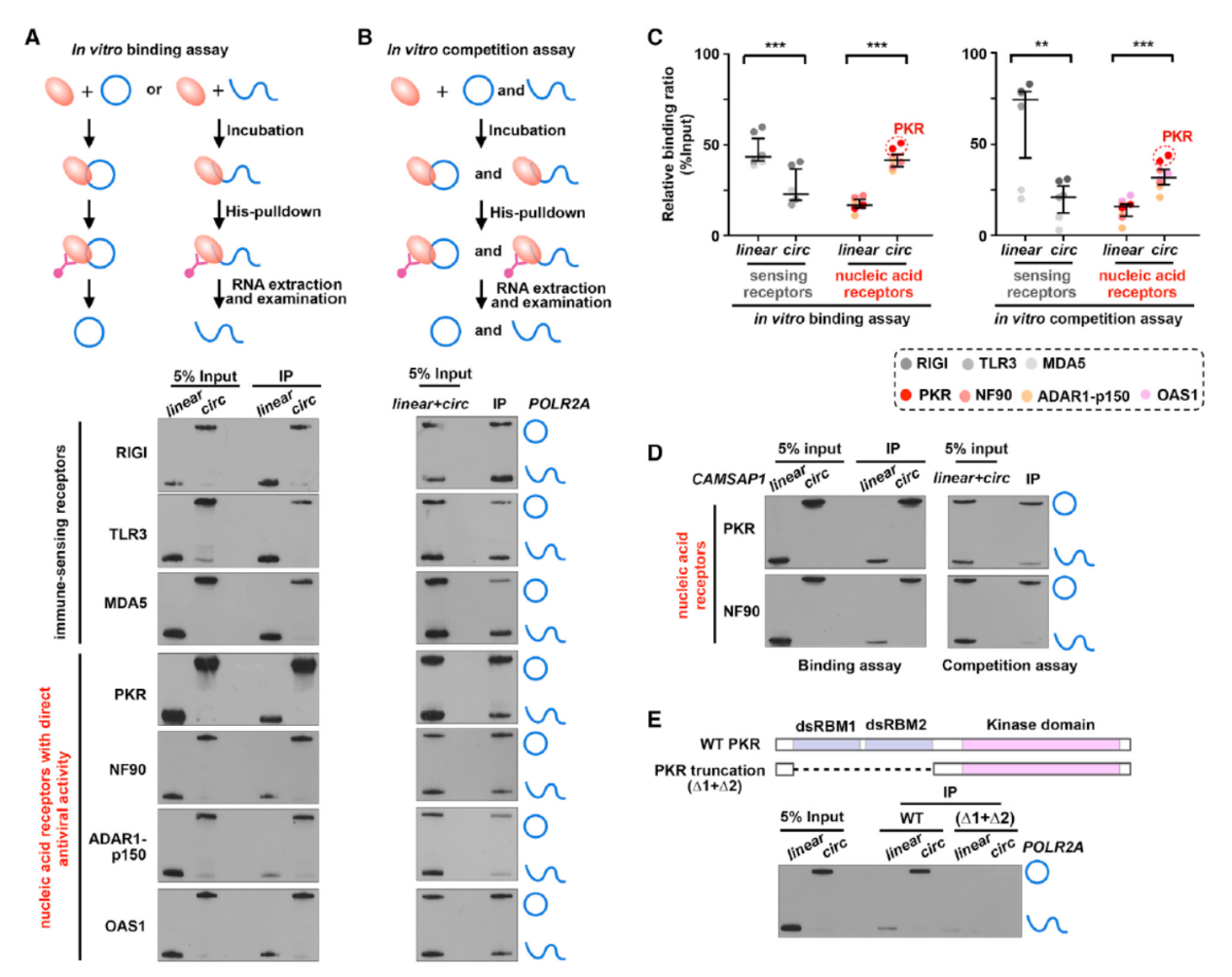
图4 circRNA结合蛋白分析 ([1])
已知PKR在结合33bp以上的dsRNA后可自磷酸化和激活,当长度达到79bp时活性最高。但小于33bp的(16-33bp范围)的dsRNA则抑制PKR的活性。表达纯化的PKR在体外可被33bp以上的dsRNA激活自磷酸化,但16-33bp的不能激活。circPOLR2A和circCAMSAP1不能激活PKR但对应的线性分子可以激活PKR。这些体外实验说明PKR具有选择性结合circRNA的特点,结合了circRNA后自身活性受到抑制。
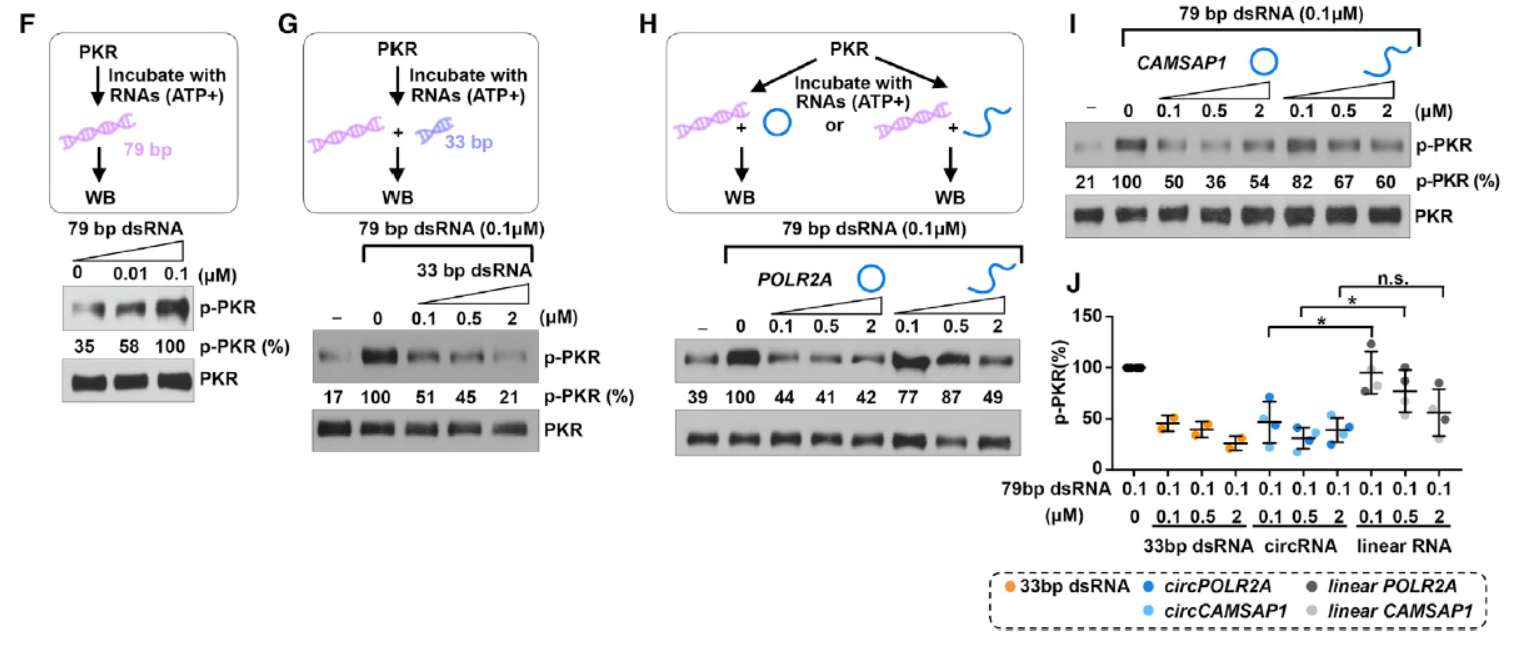
图5 PKR结合circRNA分子后不能被激活 ([1])
circRNA倾向于形成16-26bp的小颈环结构
RNA分子内部的二级结构也具有双链RNA的特点,会不会是circRNA分子内部的二级颈环结构介道了与PKR的结合并抑制了它的活性?作者通过SHAPE-MaP测序分析了34种circRNA和对应序列的线性RNA分子中二级结构的情况,其中有12种circRNA得到了对应的线性RNA结果,这些分子的分析结果表明circRNA中二级结构与对应的线性RNA有所不同。circRNA中小颈环结构更多。
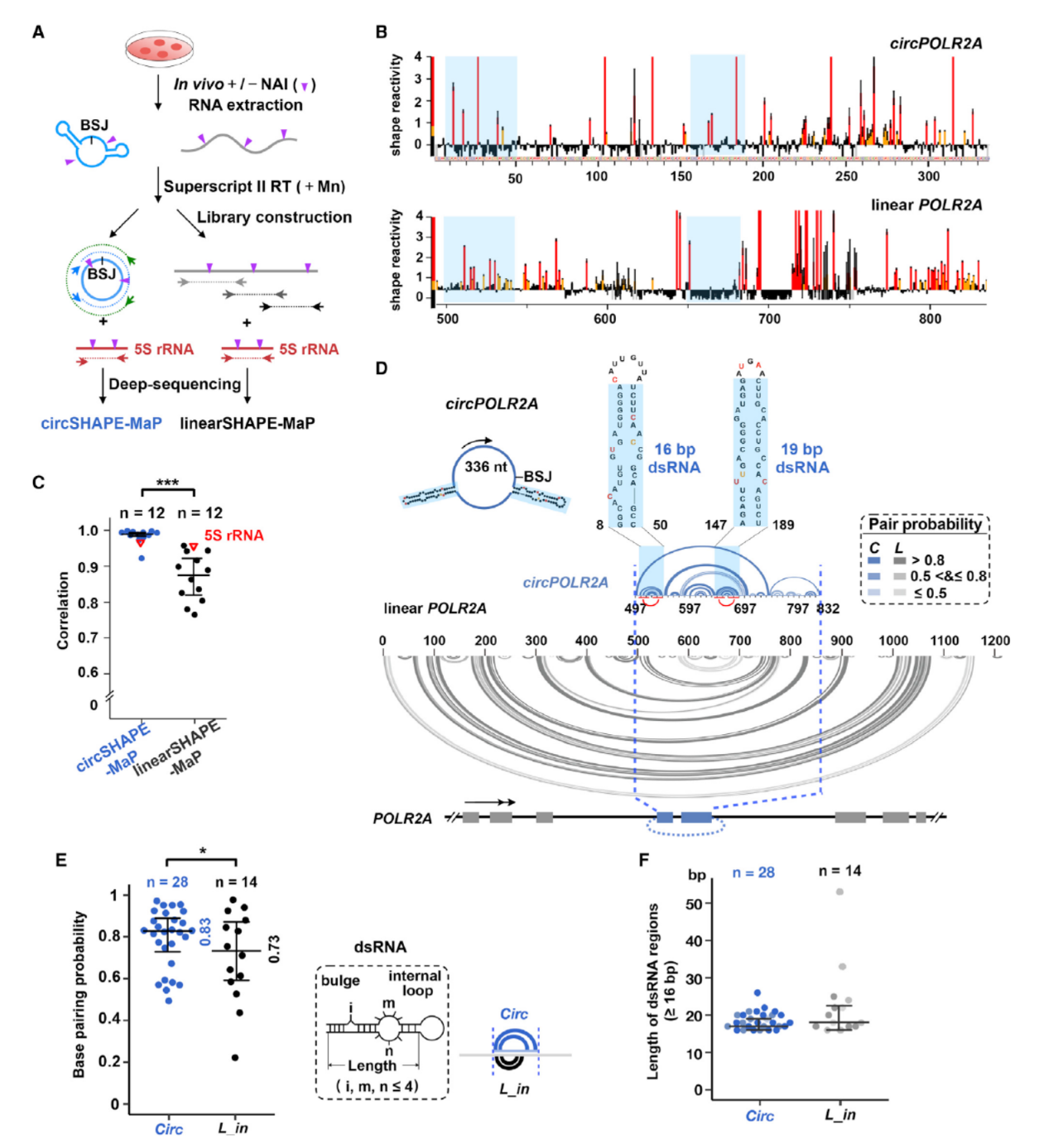
图6 circRNA倾向于形成小颈环结构 ([1])
除了上述12种circRNA分子,另外还有22种circRNA分子没有得到对应线性RNA的SHAPE-MaP结果。分析这些circRNA的结果发现其中的14种分子倾向于形成小的颈环结构。因此,在34种circRNA分子中,有26种circRNA可以形成小于33bp的小颈环结构。

图7 几种circRNA分子的二级结构分析情况 ([1])
circRNA的小颈环结构抑制PKR活性
经过上述的体外实验,初步表明circRNA分子内部的小颈环结构可以结合PKR并抑制其自磷酸化,那么这种机制是否也在细胞内存在呢?为了验证相关的机制,作者在Hela细胞中分别过表达线性和环状的POLR2A分子,然后用poly(I:C)处理,看PKR磷酸化的状态。结果表明单独过表达circPOLR2A能明显降低poly(I:C)处理后PKR的磷酸化。但换成另一种不带分子内小颈环结构的circRNA分子,circSMARCA5则不能影响PKR的磷酸化过程。在RNase L敲除的细胞中,poly(I:C)处理诱导的PKR激活作用显著减弱。
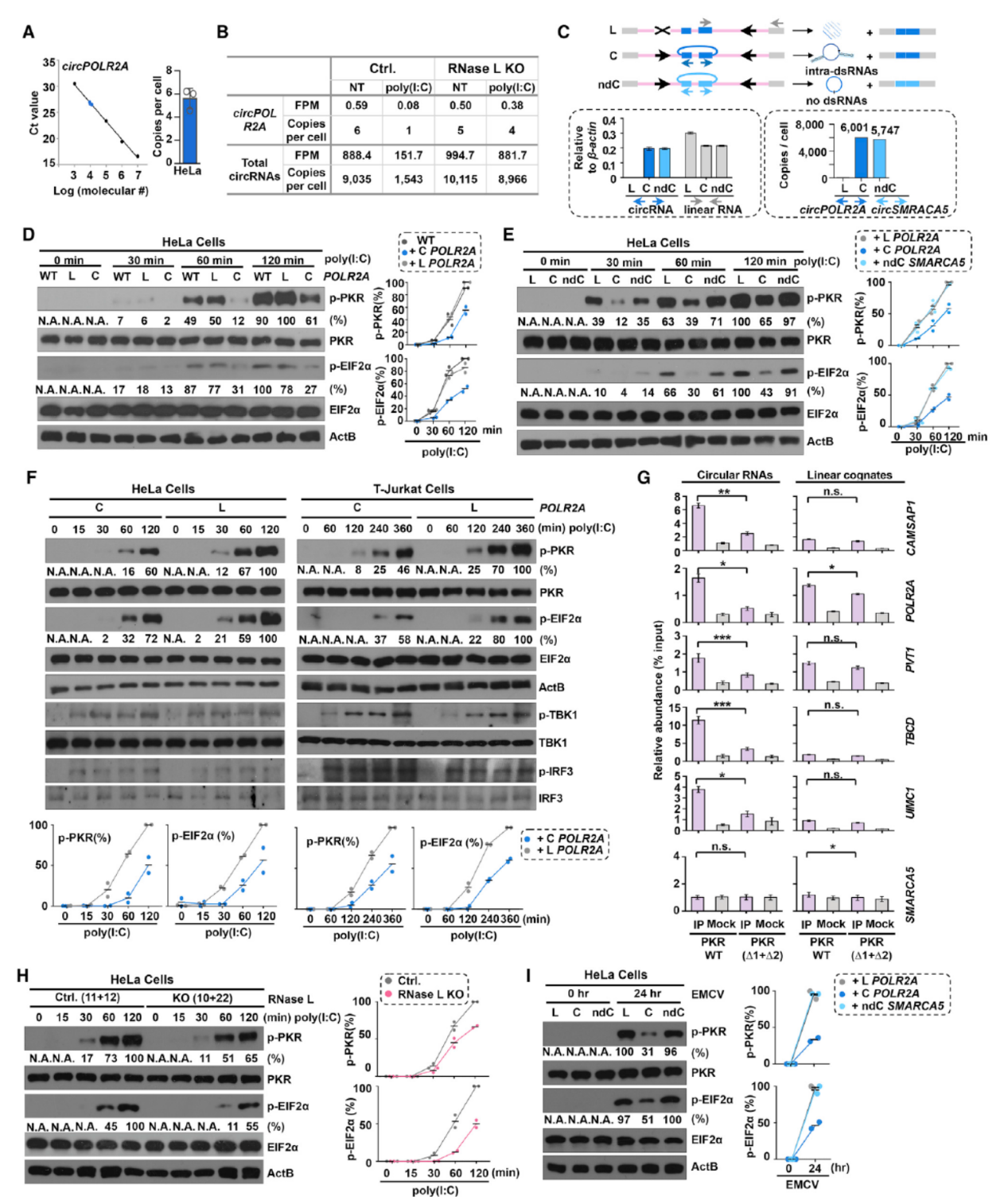
图8 circRNA小颈环结构负调控PKR的激活 ([1])
系统性红斑狼疮患者
系统性红斑狼疮(SLE)是常见的自身免疫疾病,表现为过度的免疫激活反应,SLE患者表现出PKR的过度激活状态。作者分析了SLE与健康对照者PKR蛋白表达和磷酸化状态,结果表明SLE患者PBMC中PKR的蛋白表达有微弱上调,但其磷酸化状态显著升高。QPCR结果表明SLE患者中具有内部小颈环结构的几种circRNA表达丰度显著降低,RNA-seq分析单核细胞,B细胞和T细胞中circRNA的丰度,结果表明在B细胞和T细胞中circRNA总体丰度下降。是否在SLE的病人中circRNA的降低是导致PKR过度激活的因素?于是作者选择了三个SLE患者,分离PBMC后瞬转过表达线性或环状的POLR2A,分析PKR的磷酸化情况,结果表明过表达circPOLR2A能够降低PBMC中的PKR磷酸化状态。单独分离SLE的T细胞做相应的过表达实验也表明SLE中过表达带内部小颈环结构的circRNA可以降低PKR的磷酸化水平。
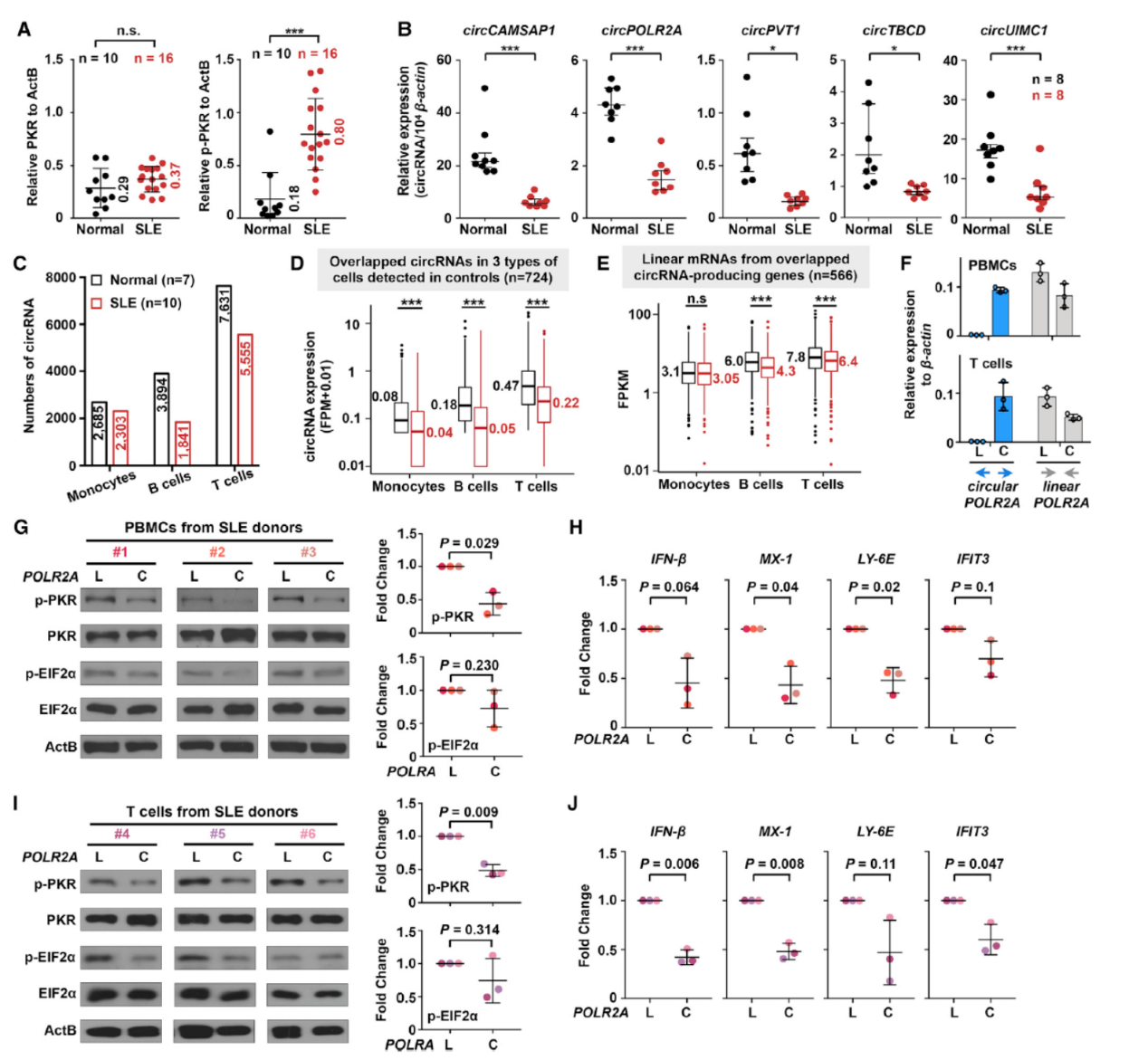
图9 红斑狼疮患者circRNA总体减少,过表达circRNA可缓解 ([1])
至此,本文的研究数据就介绍完了。从全文的故事来看,本文的主要贡献是发现了一种基于circRNA特有的内部小颈环结构负调控PKR活性,在其他刺激条件下,RNase L可介导circRNA的降解,进而释放PKR,PKR自磷酸化并激活下游通路。这一机制显示了circRNA通过竞争性结合PKR实现细胞免疫信号通路的调控作用,对于circRNA的功能研究和细胞免疫学通路机制的认知都具有重大意义。
参考文献
1. Chu-Xiao Liu, X.L., Fang Nan, Shan Jiang, Xiang Gao, Si-Kun Guo, Wei Xue, Yange Cui, Kaige Dong, Huihua Ding, Bo Qu, Zhaocai Zhou, Nan Shen, Li Yang and Ling-Ling Chen, Structure and Degradation of Circular RNAs Regulate PKR Activation in Innate Immunity. Cell, 2019.
.png)