circRNA翻译是非常受关注的研究思路,近几年已经有十余篇研究报道。4月2日,Molecular Cancer杂志发表了一项circRNA翻译蛋白的研究工作,报道结肠癌中circFNDC3B编码蛋白可以抑制Snai1表达并抑制EMT和肿瘤进展。中山大学附属第三医院郑俊和张磊,悉尼大学Storr肝病研究中心乔梁教授为本文的共同通讯作者([1])。

结肠癌中circFNDC3B的发现和鉴定
circFNDC3B由FNDC3B基因的5和6外显子形成,作者设计反向引物验证了结肠癌中circFNDC3B的存在,Sanger测序验证了接口位置的序列。RNase R实验,放线菌素D实验,FISH实验分析了circFNDC3B分子的基本情况,结果显示circFNDC3B主要定位在细胞质中。临床标本检测结果表明circFNDC3B在结肠癌中显著低表达,临床标本中,circFNDC3B表达低的患者预后更差。
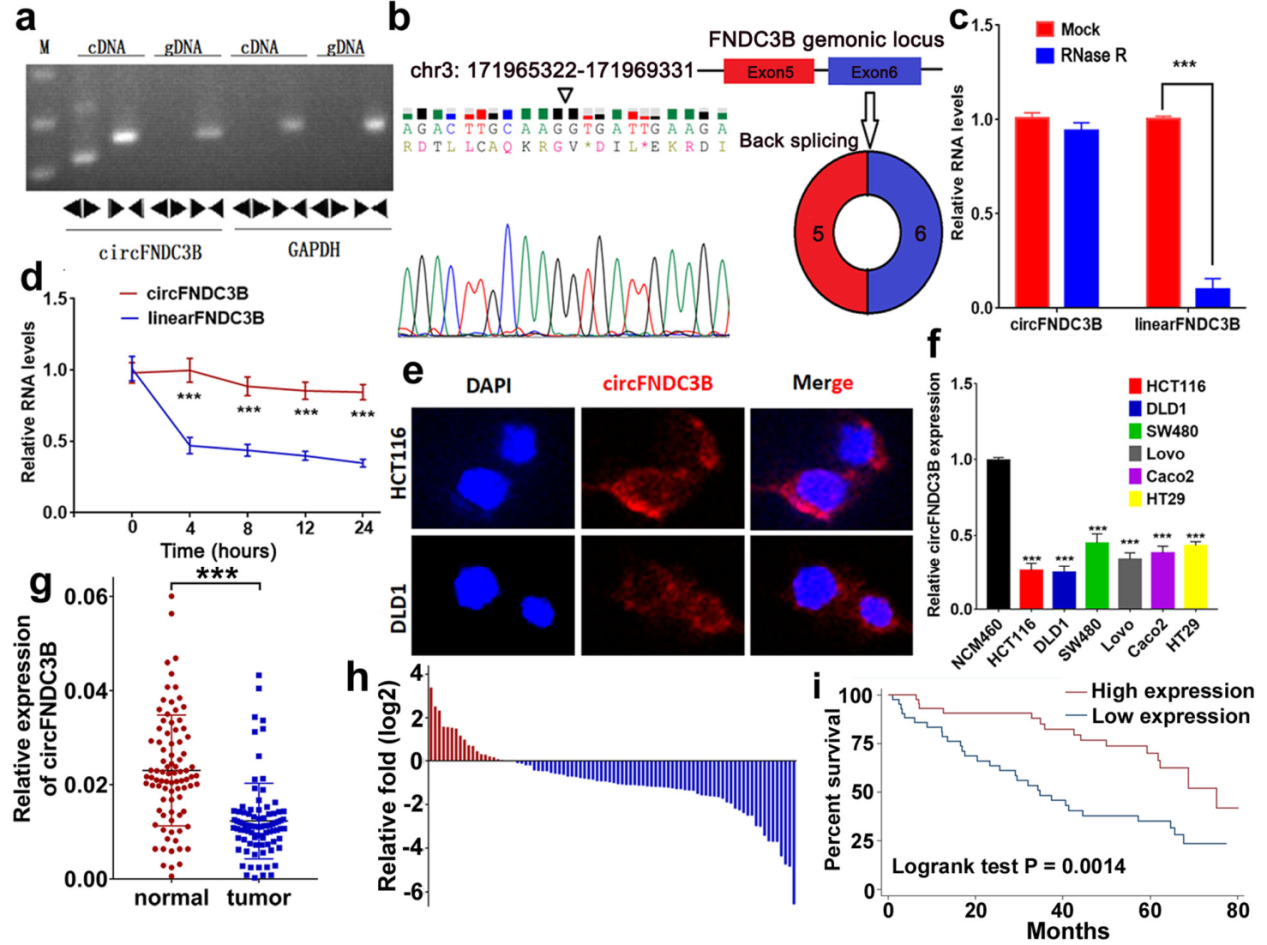
图1结肠癌中circFNDC3B的发现和鉴定 ([1])
circFNDC3B抑制细胞增殖和迁移侵袭
功能实验表明过表达circFNDC3B抑制细胞增殖和迁移侵袭,干扰circFNDC3B则促进细胞增殖和迁移侵袭。
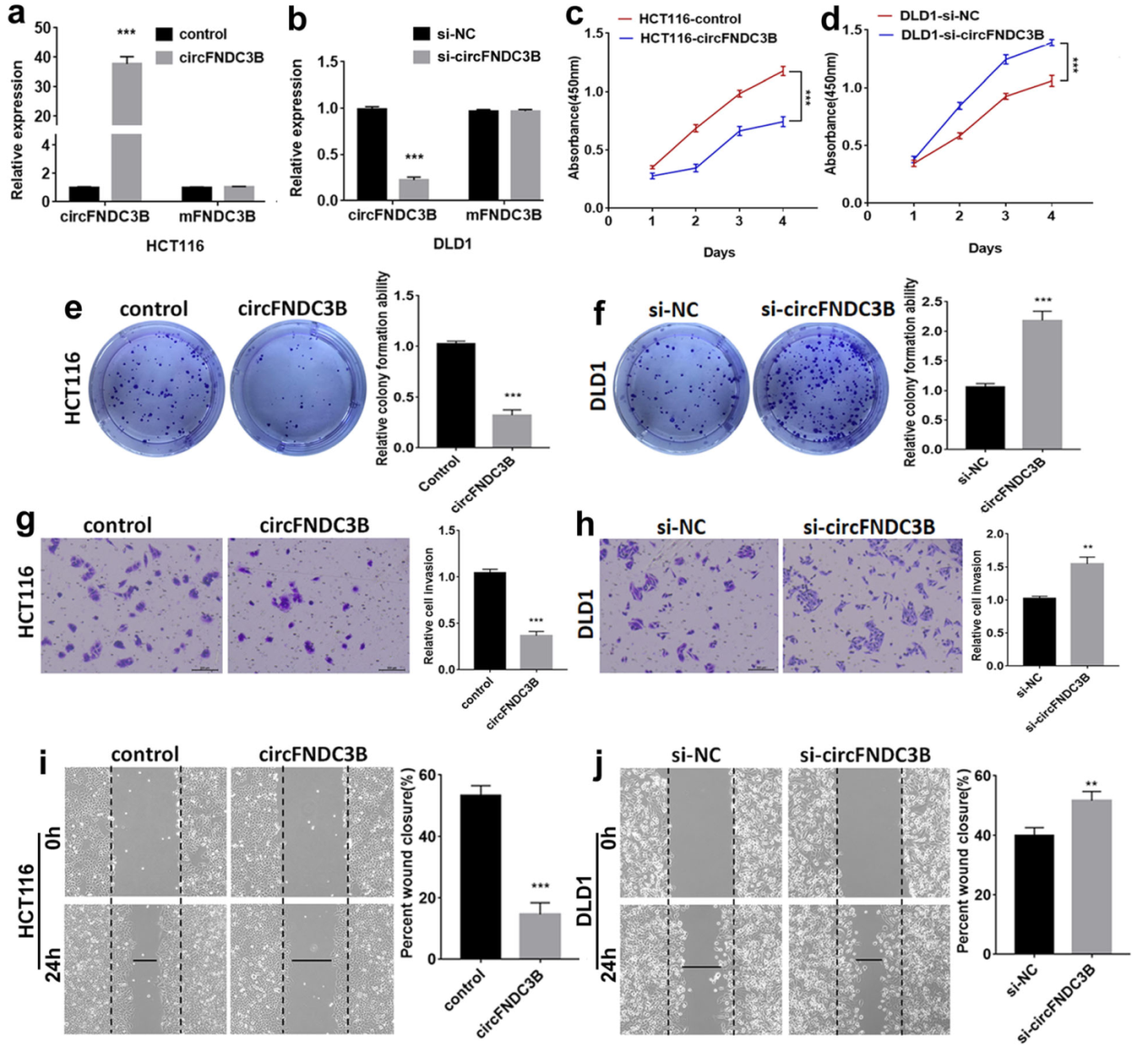
图2 circFNDC3B抑制细胞增殖和迁移侵袭 ([1])
circFNDC3B编码蛋白鉴定
序列分析表明circFNDC3B存在一个大于一圈的ORF。circFNDC3B长度526nt,这个一圈多的ORF总长度657nt,预测的蛋白序列有218aa。序列比对的结果显示这个218aa的序列的N端有一段不同于FNDC3B母基因蛋白的独有序列。ORF的上游有一段序列可能有IRES的功能,荧光素酶报告基因的验证证明了这一段的确具有IRES功能。为验证circFNDC3B的翻译产物,作者构建了四个载体进行验证分析:
(1)Lv-vector:慢病毒空载体。
(2)Lv-circFNDC3B-flag:将Flag序列融合至预测ORF中。融合位置为ORF的中间,避免了这种ORF占了一圈多的情况下在N端或C端融合导致的插入Flag序列对ORF的改变过大的问题。本文的Flag融合位置设计在93位氨基酸后面,该位置避开了ORF终止密码子的位置(circFNDC3B-218aa的终止密码子与91和92位的氨基酸有序列交叠)。
(3)Lv-circFNDC3B-flag-mut:Flag序列融合至ORF中,但其实密码子突变为ACG。
(4)Lv-circFNDC3B-218aa:直接表达线性的circFNDC3B-218aa ORF,C端融合Flag序列。
四种病毒载体感染细胞后,有circFNDC3B的载体显著增加了circRNA的表达水平,但所有的载体对FNDC3B母基因的影响都非常低。WB实验验证了circFNDC3B-218aa的翻译产物,用了两种抗体检测:一个是anti-Flag的抗体,验证了融合Flag后的circFNDC3B-218aa表达,起始密码子突变后这个条带消失。另一个是anti-FNDC3B的一种商业化抗体,也可以识别circFNDC3B-218aa,这种商业化抗体也检测到了Flag融合后的蛋白条带,同时在病毒载体表达产物不能准确翻译circFNDC3B-218aa的两组中也有很弱的条带出现,可能是细胞内源circFNDC3B-218aa产物的条带。最后,作者从IP产物的蛋白质谱中找到了具有circFNDC3B-218aa特有氨基酸序列的蛋白质谱峰。
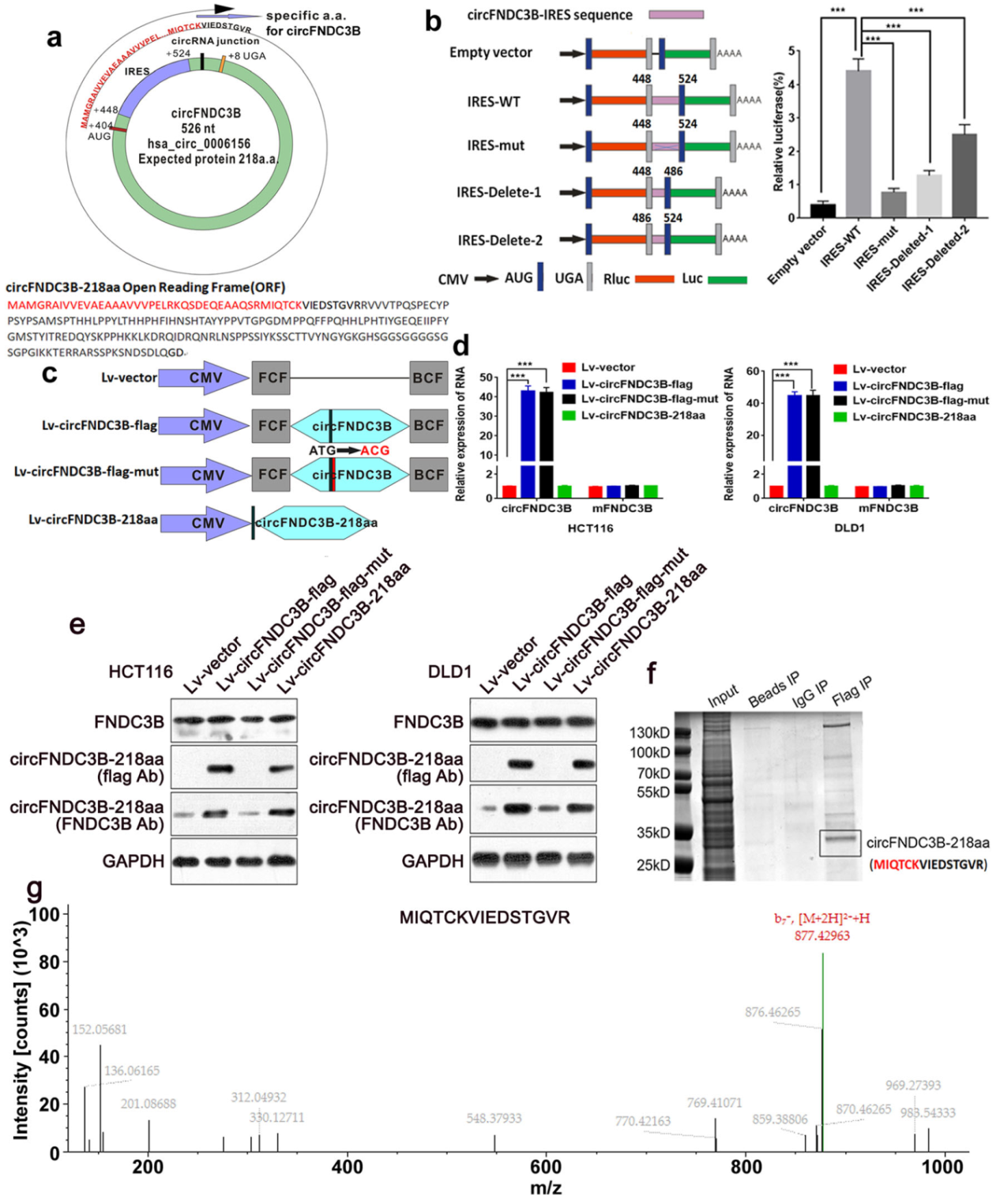
图3 circFNDC3B编码蛋白鉴定 ([1])
circFNDC3B-218aa是circFNDC3B发挥功能的关键
前面的结果中circFNDC3B具有抑制细胞增殖和迁移侵袭的作用,那么是circFNDC3B作为非编码RNA的属性起的作用,还是其编码的蛋白起的作用呢?基于上述设计的突变载体,作者分析了四种载体的功能情况,结果表明circFNDC3B-218aa是发挥功能的关键。
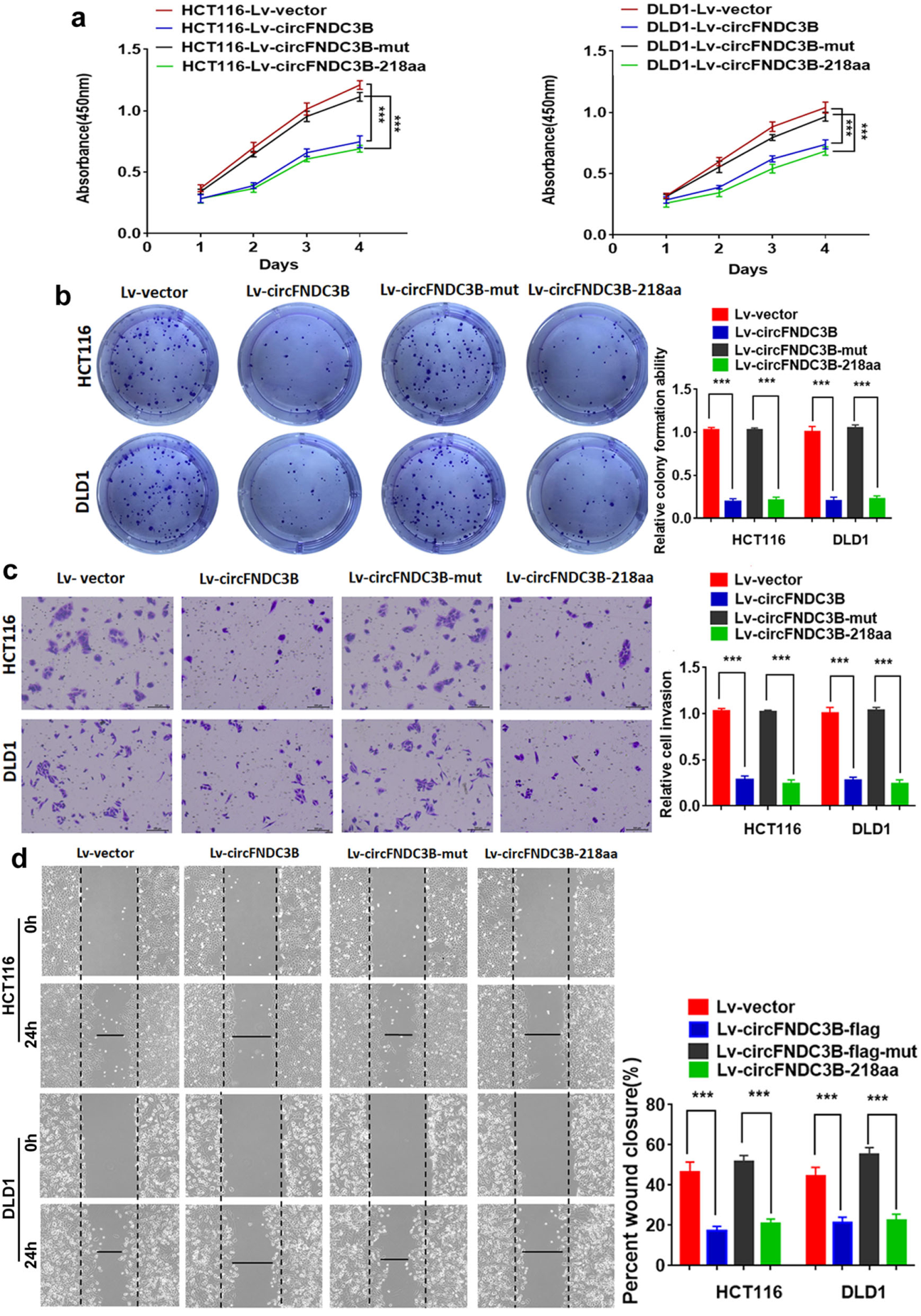
图4 circFNDC3B编码蛋白而非RNA发挥功能 ([1])
circFNDC3B-218aa体内抑制肿瘤生长
体内实验也证明circFNDC3B-218aa可显著抑制肿瘤生长速度。起始密码子突变后的circFNDC3B影响不明显。
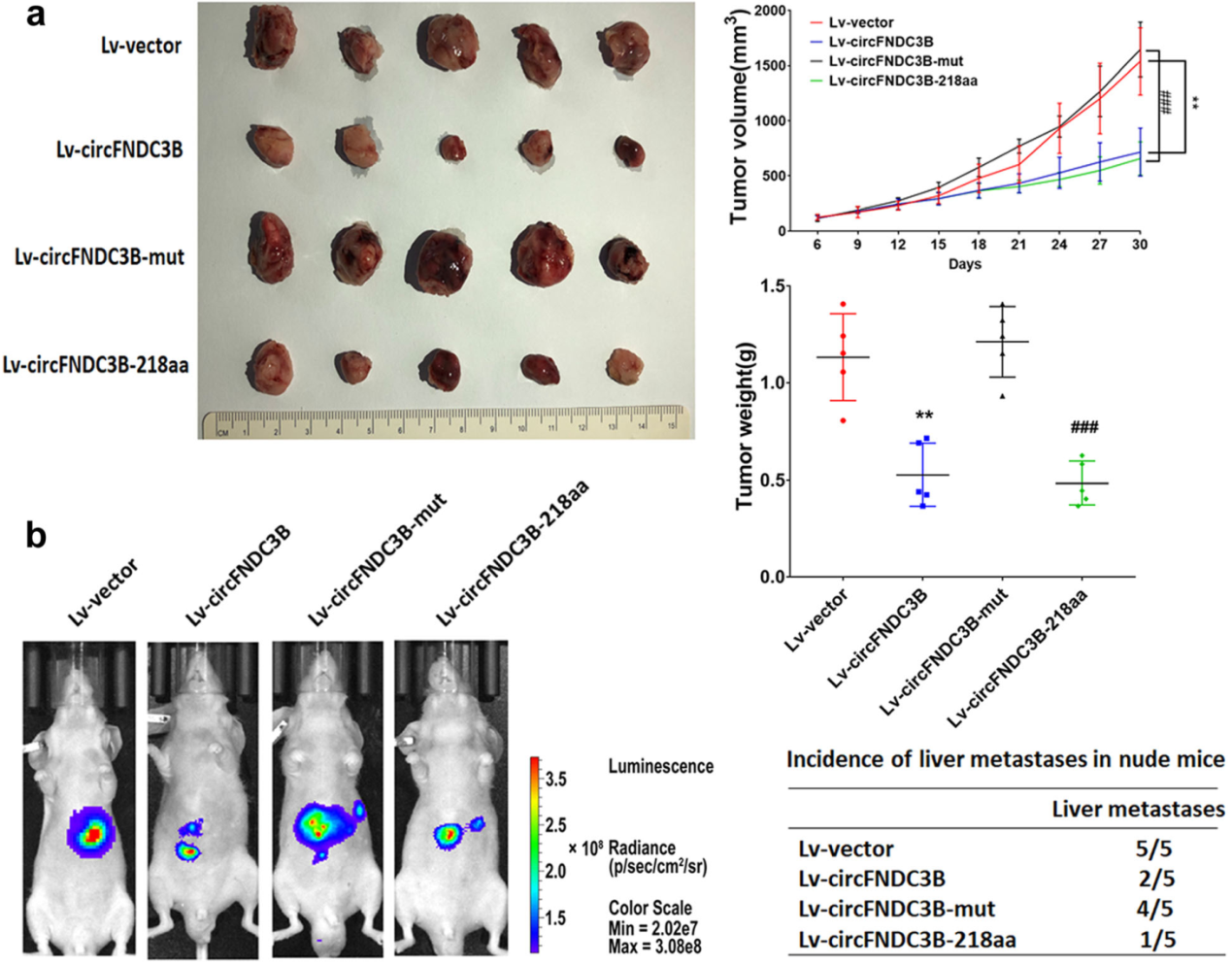
图5 circFNDC3B-218aa体内抑制肿瘤生长 ([1])
circFNDC3B-218aa调控Snai1和FBP1表达
为分析circFNDC3B-218aa的功能机制,作者通过RNA-seq分析了过表达circFNDC3B-218aa前后基因表达差异情况。发现circFNDC3B-218aa可以促进FBP1的表达而抑制Snai1的表达。细胞和动物实验的标本也验证了这些现象。
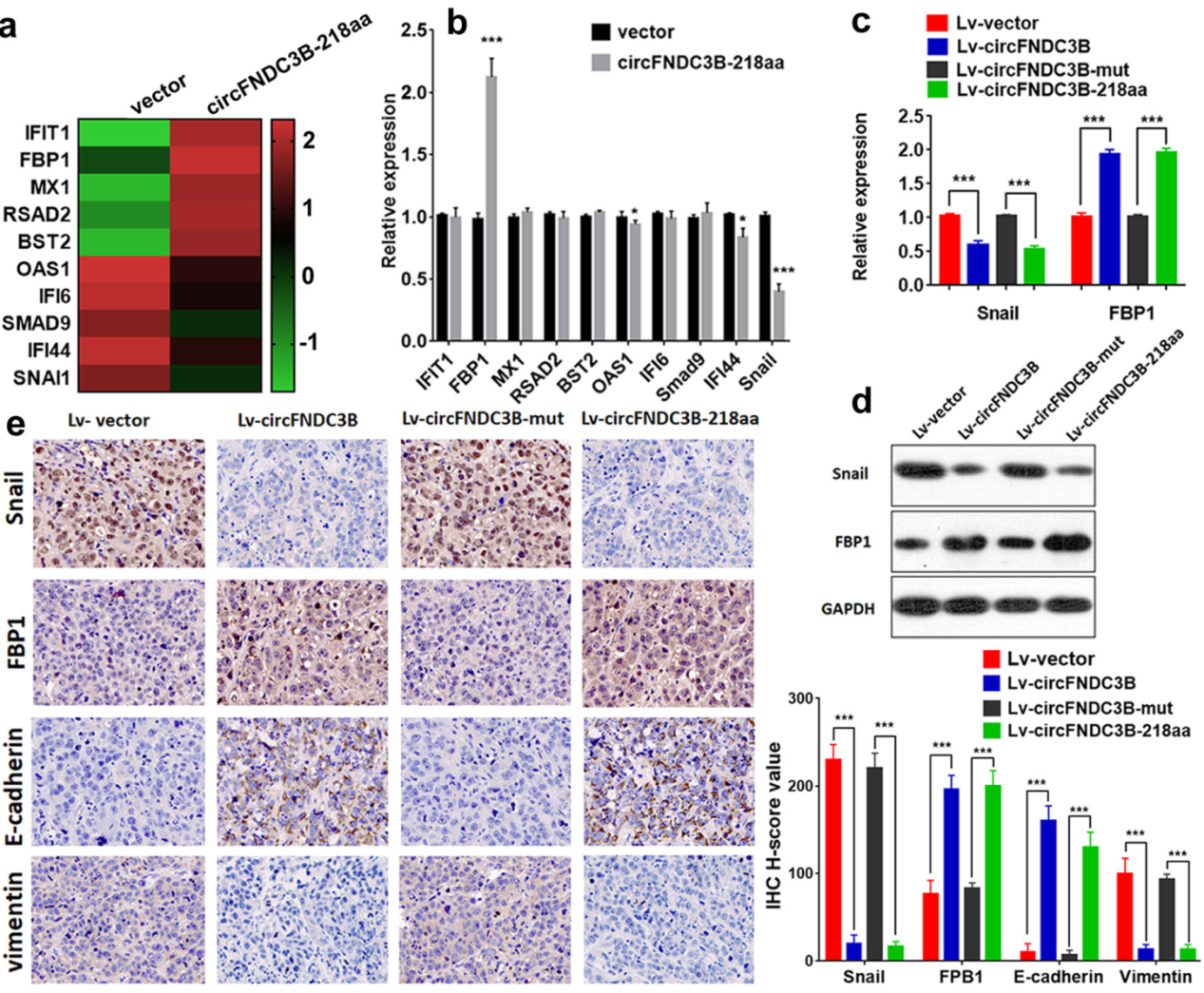
图6 circFNDC3B-218aa调控Snail和FBP1表达 ([1])
circFNDC3B-218aa通过Snai1调控FBP1,抑制EMT
已知Snai1可以负调控FBP1的表达,那么circFNDC3B-218aa是不是通过Snai1调控了FBP1的表达呢?作者通过过表达circFNDC3B-218aa后过表达Snail的实验验证了这个假设。单独过表达circFNDC3B-218aa能抑制肿瘤迁移侵袭,但同时过表达Snail能抵消单独过表达circFNDC3B-218aa的效应。
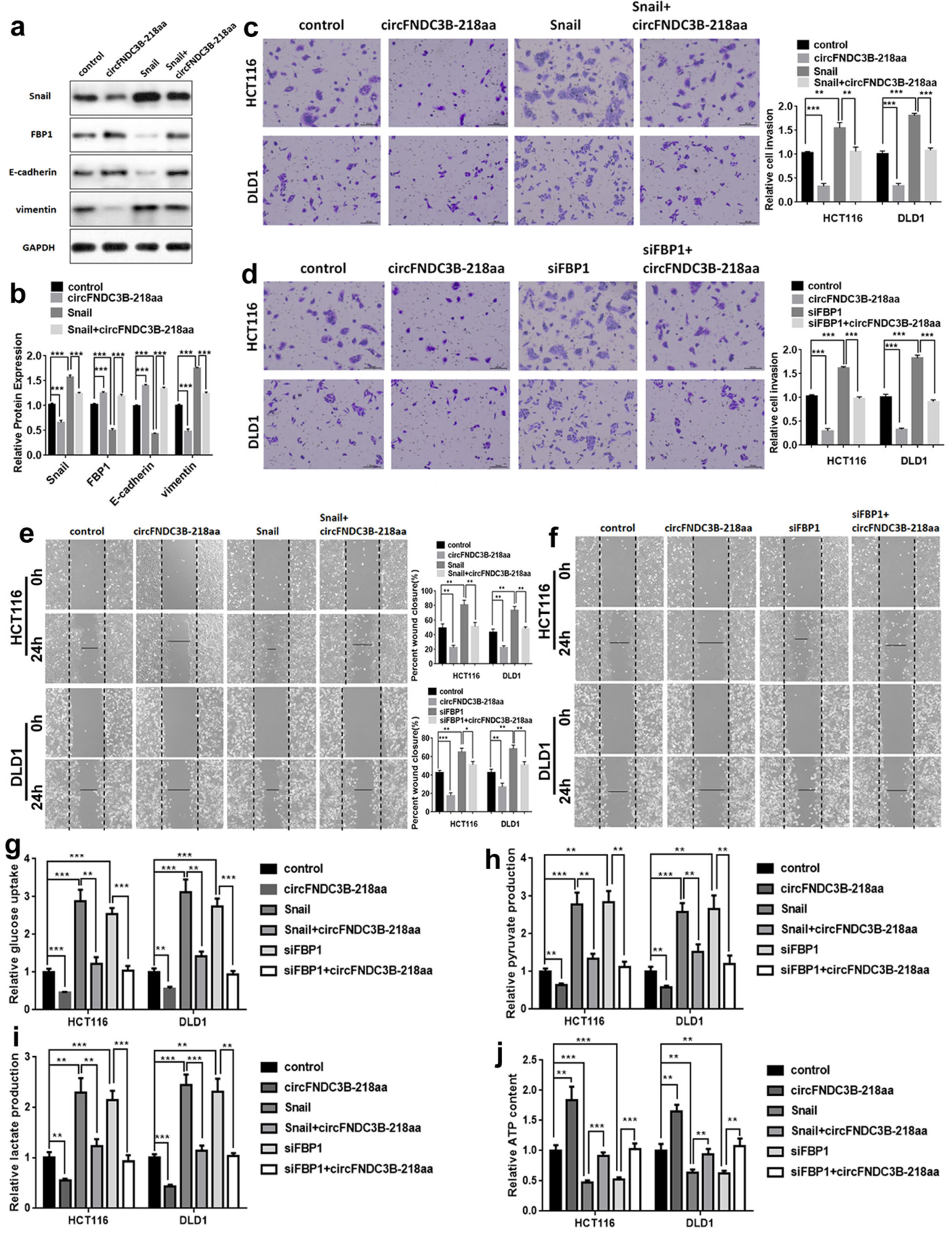
图7 circFNDC3B-218aa通过Snai1调控FBP1 ([1])
circFNDC3B-218aa功能机制模型
circFNDC3B在结肠癌中通过翻译一个218aa的蛋白,负调控Snai1的表达,进而释放了Snai1对FBP1的抑制效应,FBP1进而抑制EMT,抑制肿瘤进展。
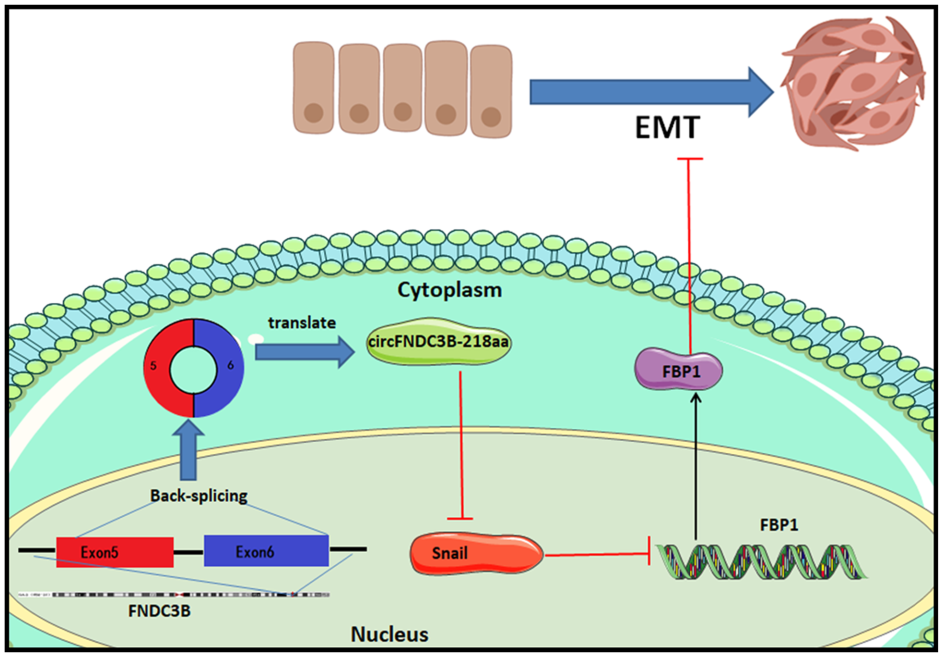
图8 circFNDC3B-218aa功能机制模型 ([1])
本文关于circRNA翻译蛋白的研究相对比较全面,对于circRNA翻译产物的验证和鉴定有较高的参考价值。美中不足的是对天然表达的circFNDC3B-218aa蛋白的WB验证实验证据偏少,只有在商业化抗体验证的实验中有两个对照组的条带结果,如果能在细胞系(如NCM460细胞等非肿瘤细胞系)或病人标本组织(癌旁组织,非肿瘤的结肠组织等等)中验证一下天然的circFNDC3B-218aa分子就更全面了。
参考文献
1. Pan, Z., et al., A novel protein encoded by circFNDC3B inhibits tumor progression and EMT through regulating Snail in colon cancer. Mol Cancer, 2020. 19(1): p. 71.
.png)