2019年12月21日,俄克拉荷马大学Chuanbin Mao和上海第四人民医院Liu Shanrong为共同通讯作者在ADVANCED SCIENCE (IF= 15.804)杂志上发表了一篇题为“Circ-MALAT1 Functions as Both an mRNA Translation Brake and a microRNA Sponge to Promote Self-Renewal of Hepatocellular Cancer Stem Cells”的文章,报道在肝癌肿瘤干细胞(CSC)中发现了高表达的环状RNA,circ-MALAT1。该分子通过两种方式发挥功能:一方面,circ-MALAT1通过海绵miRNA(miR-6887-3p)上调癌基因(JAK2)和增加磷酸化JAK2,增强JAK2/STAT3信号通路,从而积极地促进CSC的自我更新:另一方面,circ-MALAT1可以通过抑制mRNA翻译过程,直接抑制PAX5 mRNA的翻译,这种mRNA Translation Brake是一种全新的circRNA功能机制形式,值得关注([1])。。

肝癌是我国高发的,危害极大的恶性肿瘤。它的发生与肿瘤干细胞无限制的增殖有着密不可分的联系。肿瘤干细胞(Cancer stem cell,CSC)具有无限制自我更新和分化的特性,被认为是肿瘤发生、发展和转移的起源。高比例的CSC可以加速肿瘤转变成癌症,其对治疗还有强烈的抗性,这也是导致癌症发生的主要原因。目前有研究表明,circRNA在肿瘤的发生、发展和转移中有潜在的作用。虽然CSC和circRNA均与肿瘤的发生和发展有联系,但是circRNA在这方面是如何调控CSC的还不清楚。
原发性肝癌的肿瘤干细胞和粘附细胞circRNA的表达差异和验证
作者首先从患者实体瘤中分离出原发性肝癌(HCC)细胞,并通过悬浮培养获得CSC,之后,在5对HCC肿瘤组织(5例CSC和5例粘附细胞),利用高通量的CircRNA-seq技术,检测出circRNA转录本的表达差异。相比于对照细胞,18个circRNA在CSC中特异表达,根据表达差异倍数选取9个circRNA进行验证。设计circRNA的convergent primers和 divergent primers,根据其在cDNA和基因组DNA的扩增结果,来证实9个circRNAs为环状。此外,进行RNase R处理的反转录聚合酶链反应(qRT-PCR)进一步证实了上述结果。由于circ-MALAT1在CSC和粘附细胞的表达量最高,因此选择进行进一步研究。
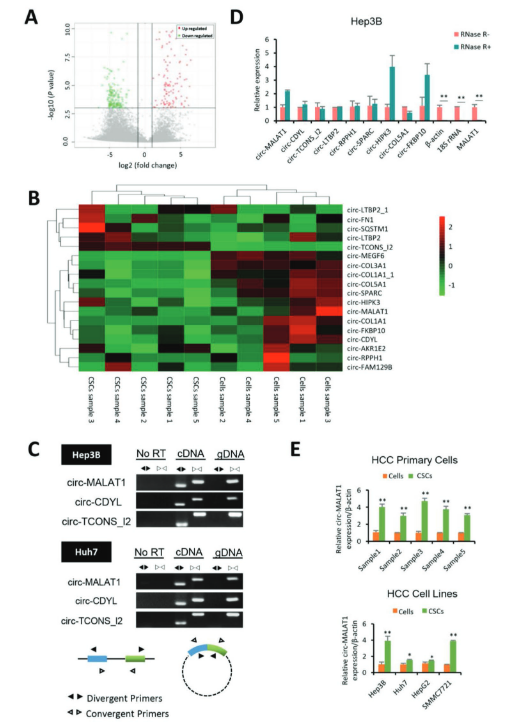
图1 肝癌干细胞中circ-MALAT1表达鉴定 ([1])
circ-MALAT1促进了肝癌CSC的自我更新
作者通过向Hep3B细胞系与Huh7细胞系中转染circ-MALAT1质粒过表达circ-MALAT1。在Hep3B细胞系中,circ-MALAT1过表达细胞形成了更多的原代、次级和三级悬浮球体。更重要的是,作者评估了稳定过表达circ-MALAT1的Huh7细胞移植瘤的生长情况。体内注射过表达circ-MALAT1的细胞导致比对照细胞更大的肿瘤尺寸、更高的肿瘤重量和更快的肿瘤生长速度。
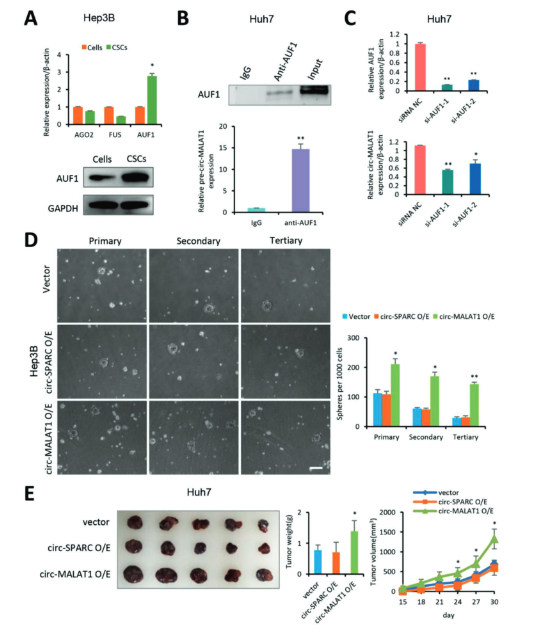
图2 circ-MALAT1与CSC干性的关系 ([1])
circ-MALAT1促进了CSC的自我更新的潜在机制
为了了解circ-MALAT1调节肝细胞CSC自我更新的机制,作者重点研究了circ-MALAT1相关的下游蛋白。对原发性肝癌的CSC进行蛋白芯片检测,有224个蛋白质上调,43个蛋白质下调。在224个上调蛋白中,96个蛋白与CSC自我更新或肿瘤转移和增殖相关。43个下调的蛋白质中有10个与肿瘤抑制相关。WB结果显示,在Hep3B中,过表达circ-MALAT1会使janus-activated kinase 2 (JAK2)表达显著升高和Paired box 5 (PAX5)表达显著下降。在原发性HCC或者HCC细胞系中,均显示CSC相比较于对照细胞,JAK2的表达高,PAX5的表达低。综上所述,这些结果强烈表明circ-MALAT1可导致肝脏CSC中JAK2上调和PAX5下调。分别对这两个通路进一步探索。
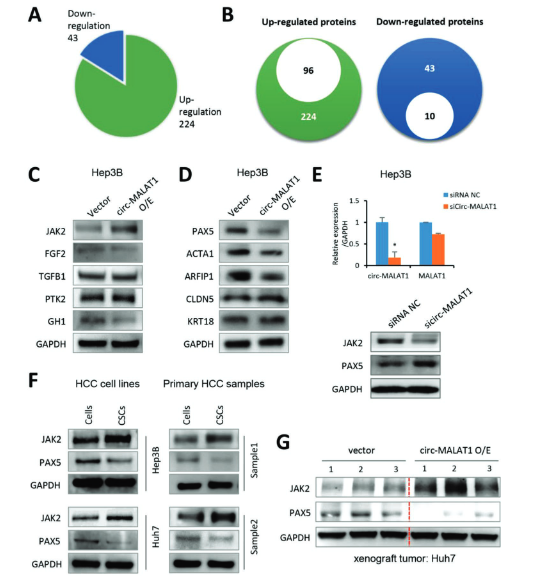
图3 circ-MALAT1调控CSC干性的机制 ([1])
circ-MALAT1、核糖体和PAX5形成三元复合物来阻止PAX5的翻译
作者通过FISH发现circ-MALAT1定位在细胞质中,它的过表达并不会影响PAX5的mRNA水平,其对PAX5的作用发生在转录后水平。circ-MALAT1上有两个IRES和一个含有11个碱基的区域。RIP、qRT-PCR、RNA pull down、IRES和11个碱基突变实验证实了circ-MALAT1分别通过IRES和11个碱基与核糖体和PAX5 mRNA 形成三元复合物来阻止PAX5的翻译,并且这种结合具有序列特异性。
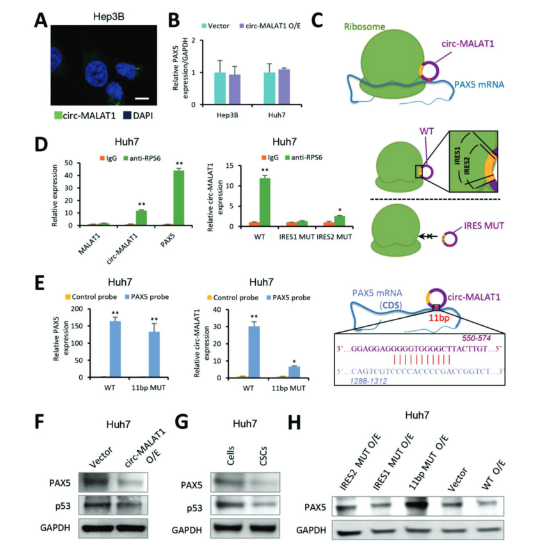
图4 circ-MALAT1作为mRNA Brake抑制PAX5翻译 ([1])
circ-MALAT1-miR-6887-3p-JAK2轴促进肿瘤干细胞的自我更新
另一方面,作者对JAK2这一通路进行探索,通过对circ-MALAT1和JAK2共同作用分子的预测及其验证,发现了circ-MALAT1可以下调miR-6887-3p,进而去抑制了它的靶标JAK2。WB检测JAK2其相关通路蛋白,JAK2/STAT3信号通路中的三个关键蛋白分子JAK2、磷酸化JAK2(p-JAK2)和磷酸化STAT3(p-STAT3)也被证实在CSC中上调。进一步的移植瘤实验中过表达/敲低miR-6887-3P会使JAK2表达量下降/上升和移植瘤生长减慢/加快。以上实验得出,CSC中circ-MALAT1的上调可以抑制miR-6887-3p,从而增强JAK2/STAT3途径的活性,促进CSC的自我更新。
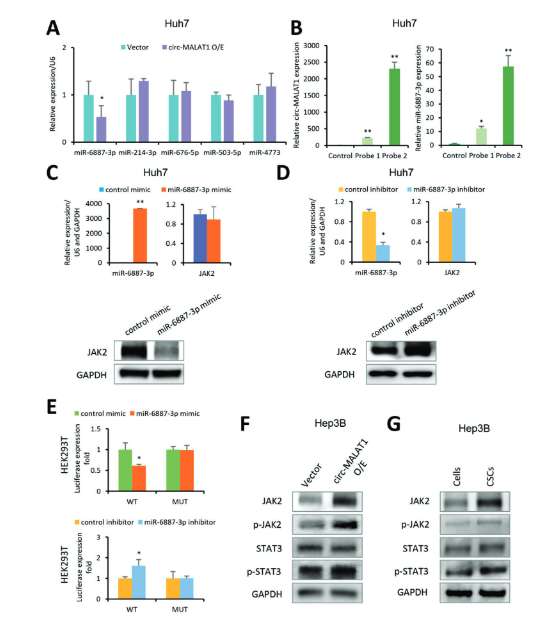
图5 circ-MALAT1通过抑制miR-6887-3p表达,调控JAK2/STAT3途径 ([1])
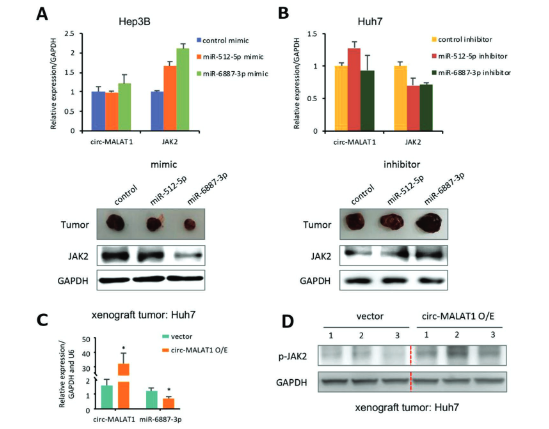
图6 体内实验验证circ-MALAT1竞争性结合miR-6887-3p ([1])
参考文献1. Chen, L., et al., Circ-MALAT1 Functions as Both an mRNA Translation Brake and a microRNA Sponge to Promote Self-Renewal of Hepatocellular Cancer Stem Cells. Adv Sci (Weinh), 2020. 7(4): p. 1900949.
.png)