常规circRNA测序往往需要较多的样本量来获得足够的RNA,以满足后续建库测序要求。目前circRNA文库的建库起始量已可以降低到2μg,但对于一些难扩培的细胞,特殊的组织,血清血浆以及外泌体等样本而言,获取足够多的RNA仍然十分困难。
一种新的基于Tn5转座酶的转录组快速建库方法
1月27日,PNAS上发表了一篇名为“RNA sequencing by direct tagmentation of RNA/DNA hybrids”的研究论文,该论文由北京大学的黄岩谊课题组、谢晓亮课题组与清华大学王建斌课题组合作完成。文章中开发了一种新的基于Tn5转座酶的转录组测序快速建库方法,并命名为SHERRY(Sequencing HEteRo RNA-DNA-hYbrid )。该方法与目前常用的转录组测序建库方法相比,大大简化了建库的过程;更值得关注的是该方法适用于微量样本及单细胞样本,对目前正肆虐的新型冠状病毒等样本的测序质量和速度也有望显著提升。
Tn5转座酶广泛应用于DNA测序建库技术中,包括常见的基因组测序文库及近年来比较热门的ATAC-seq文库等。Tn5转座酶复合体可直接作用于双链DNA,将其片段化并,使DNA片段两端带上特定的接头序列,再经过PCR扩增即可完成文库构建(图1)。
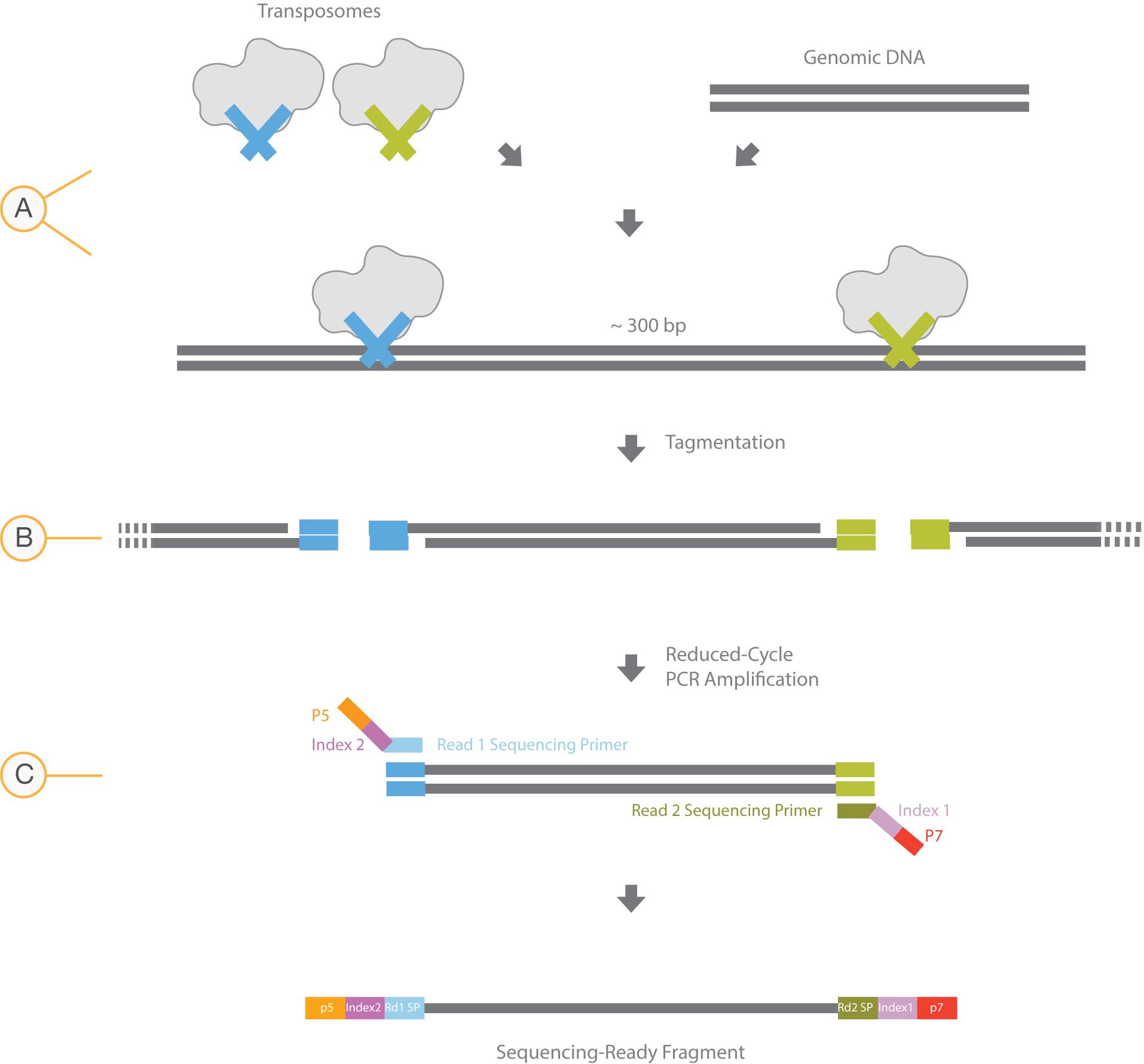
图1 Tn5转座酶DNA建库流程图(图片来源Illumina)
该论文研究发现,Tn5转座酶也能以类似方式直接识别RNA/DNA杂交链并对其进行切割与连接。SHERRY转录组测序建库流程如图2所示,分离提取的总RNA或单细胞裂解物经过oligo-dT引物反转录后,合成的RNA/DNA杂交链用Tn5转座酶复合体进行打断,并在杂交链两端加上通用的接头序列,再进行文库PCR。整个建库流程非常的简洁明快,仅5个步骤,与传统RNA建库技术相比,绕开了cDNA二链合成、末端修复加A、接头连接等繁琐的操作及纯化步骤。
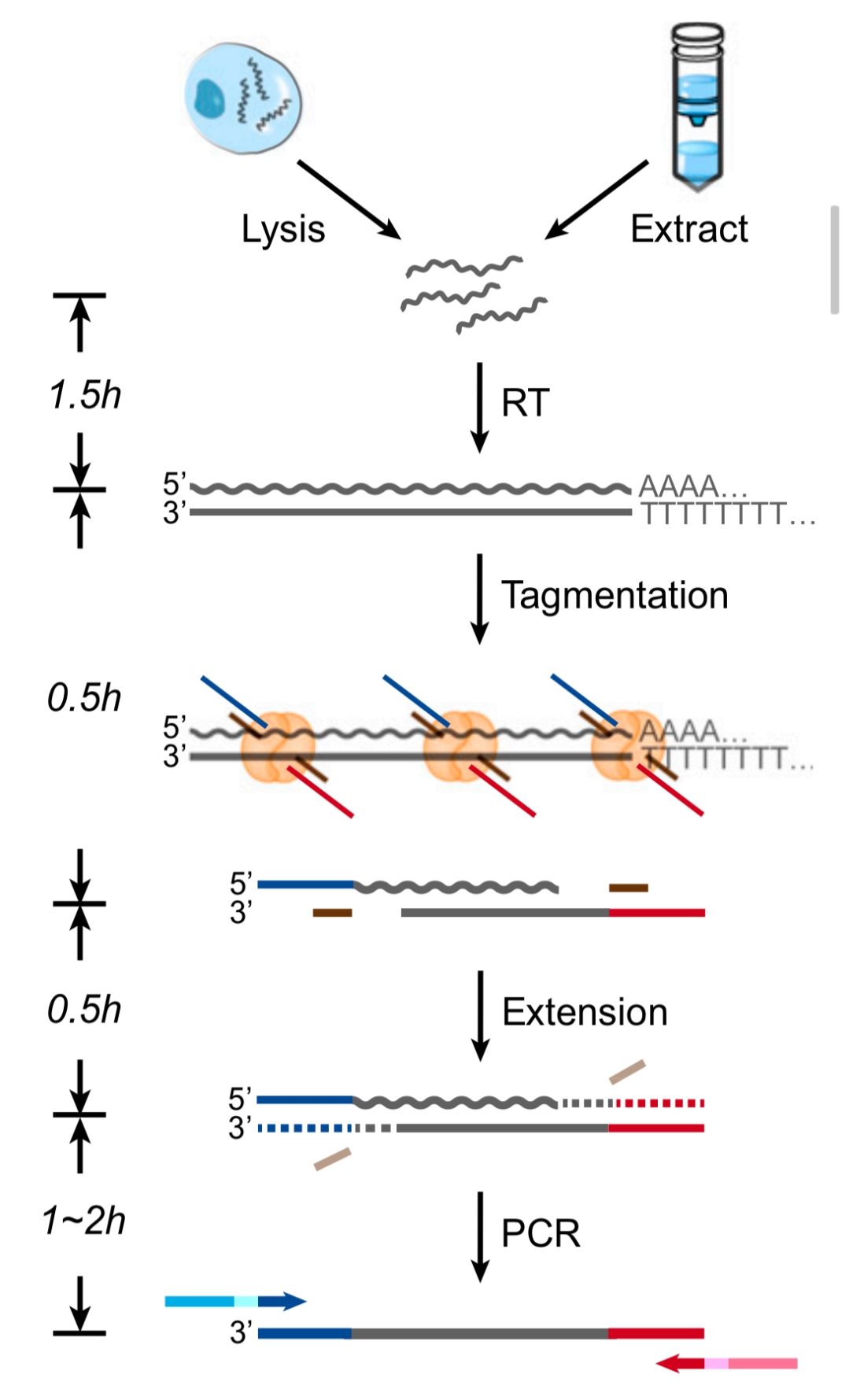
图2 SHEERY转录组建库流程图
SHEERY与常见商品化建库试剂盒比较
文中将SHERRY和scSHERRY方法分别与RNA-seq常用商品化建库试剂盒NEBNext Ultra II Kit及单细胞转录组建库试剂盒Smart-seq2进行比较(图3)。从技术流程及成本来看,SHEERY方法操作简单,耗时短,试剂成本更低,相比其他两种方法具有明显的优势。从数据分析结果来看,在不同的RNA起始量(10ng和200 ng)条件下,与NEB试剂盒的测序质量相差不大,差异表达基因结果一致性较好(图4)。在低起始量方面(100pg RNA),SHERRY有不错的性能表现,reads匹配率较高,基因检出数量近9000个,且重复性较好(图5)。在单细胞转录组方面,与smartseq2 相比,reads匹配率偏低,但具有较低的GC偏好性。当然,该技术也有一些不足,例如Tn5转座酶对杂交链的打断效果不如双链DNA以及使用oligo-dT引物进行反转录带来的3’端偏好性等。总体而言,SHERRY在转录组测序应用上具有极大的竞争力。
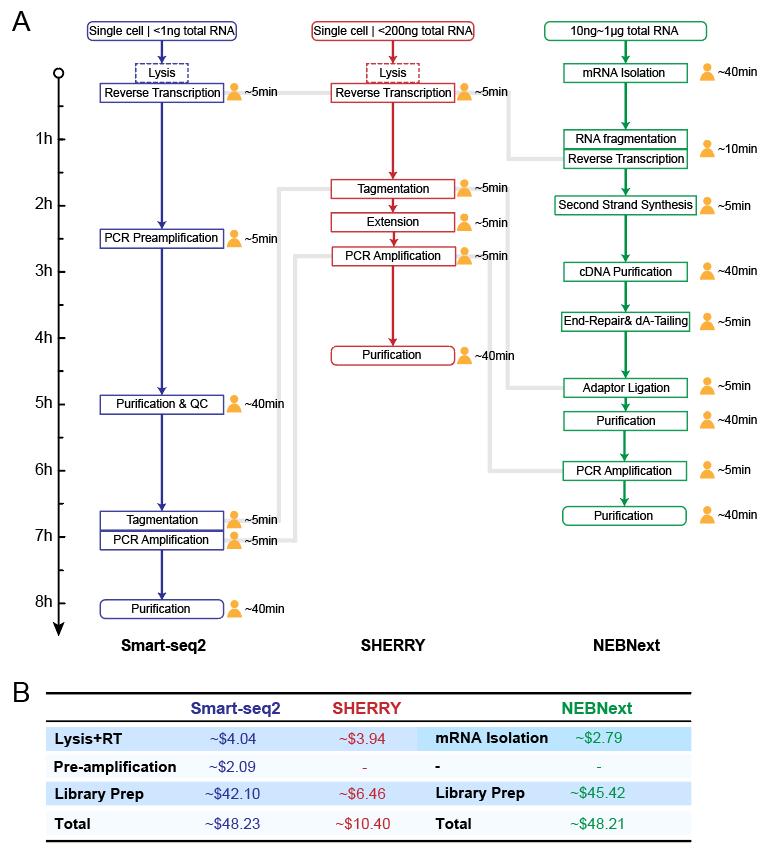
图3 三种方法的建库流程及成本比较
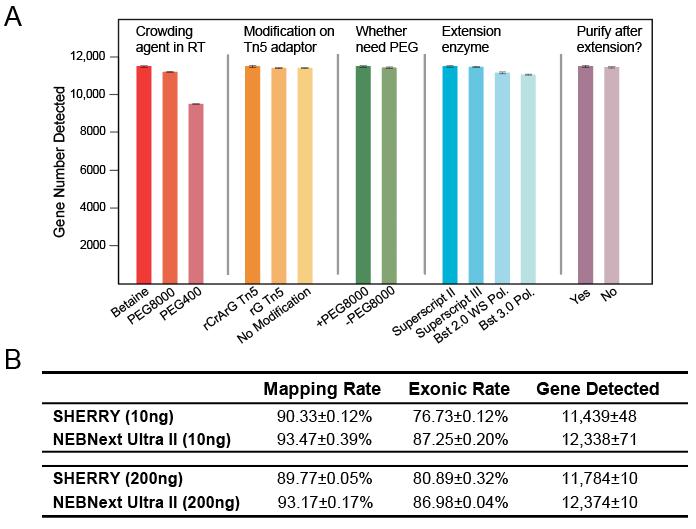
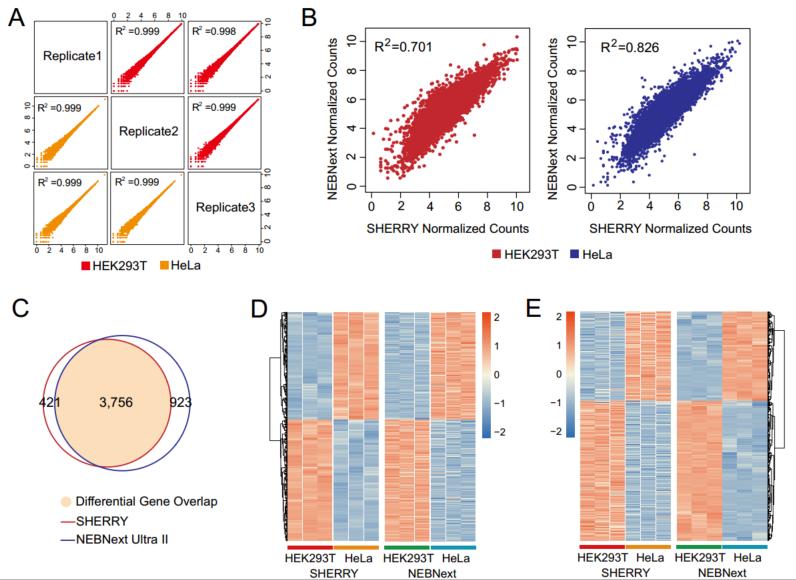
图4 SHEERY与NEBNext两种方法测序数据结果比较
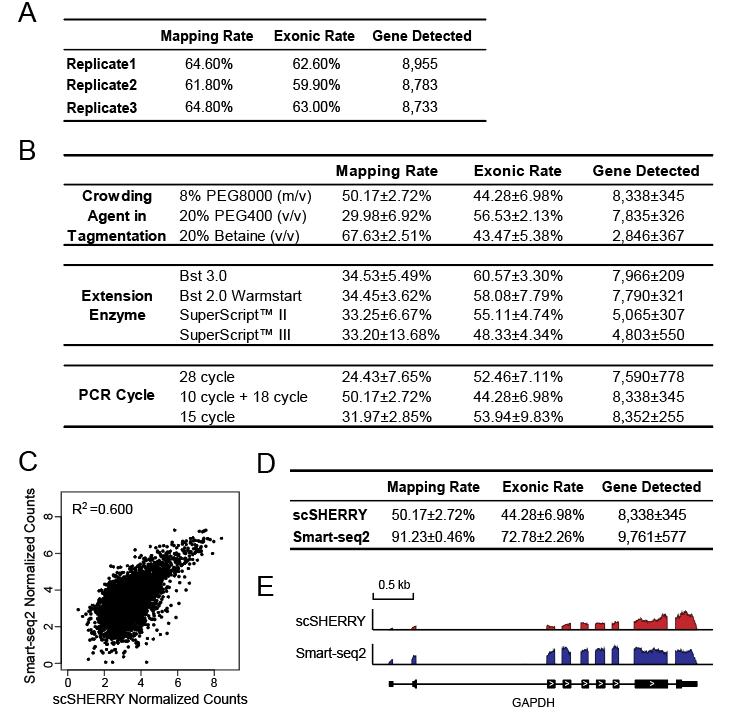
图5 基于100pg RNA起始量SHEERY法测序数据结果
SHEERY或可用于微量样本的circRNA测序
文章中开发的SHEERY方法采用polyT引物进行反转录,并不适用于circRNA测序(大多数circRNA不含polyA),但无疑为circRNA文库构建提供了新的技术思路。常见的circRNA建库流程是在传统lincRNA建库方法上增加去除线性RNA步骤,整个建库流程包含的操作及纯化步骤较多,而总RNA中的circRNA含量相对较低,每一步的磁珠纯化都会带来样本损耗,因此需要足够的RNA起始量来保证建库成功率及文库质量。对于血清血浆及外泌体等来源的RNA样本,浓度低,总量不足,circRNA建库测序难度大大增加。如果能将SHEERY快速建库方法加以改进,如合成cDNA一链时采用随机引物进行逆转录,并应用到circRNA建库技术中,不仅能降低目前的建库成本、简化建库流程、缩短建库时间,更有望实现微量样本的circRNA测序。
参考文献
RNA sequencing by direct tagmentation of RNA/DNA hybrids. PNAS.2020
www.pnas.org/cgi/doi/10.1073/pnas.1919800117
.png)