5月30日,Cell杂志发表了一项关于心脏翻译组学的研究工作,以Resource形式发表,系统分析了心脏组织中能被翻译的RNA分子,心脏中RNA翻译的规律和机制,研究中发现了一些非编码RNA来源的翻译产物,其中包括circRNA[1]。文章的通讯作者是德国柏林Max Delbruck分子医学中心的Sebastiaan van Heesch和Norbert Hubner。
本文作者分析了80例人心脏组织的翻译组学(其中65例扩张型心肌病,15例健康对照),发现了心脏组织特异的蛋白翻译机制。在捕获的可翻译的RNA分子中发现了169种lncRNA,40种circRNA,进一步佐证了非编码RNA,包括circRNA能被翻译的事实。由于本文的信息量比较大,关于心脏组织中翻译组学和翻译调控机制的介绍不在此做具体详细的解读,只选择一部分比较有趣的发现,感兴趣的可以从原文中了解更具体的内容。
那么什么是翻译组学?如何从翻译组学中发现lncRNA和circRNA可以被翻译?本文发现了哪些circRNA能被翻译?带着这些有趣的问题,我们一起来学习这篇文章:
什么是翻译组学?
翻译组学是研究正在翻译的RNA分子的高通量分析技术的泛称,常用的翻译组学研究方法是基于核糖体印迹分析(Ribosome Profiling)进行高通量测序分析,大致的技术流程是利用超速离心等技术分离核糖体,然后用RNase消化没有被核糖体覆盖的RNA区域,再纯化得到被核糖体保护的RNA片段,建库后高通量测序[2]。
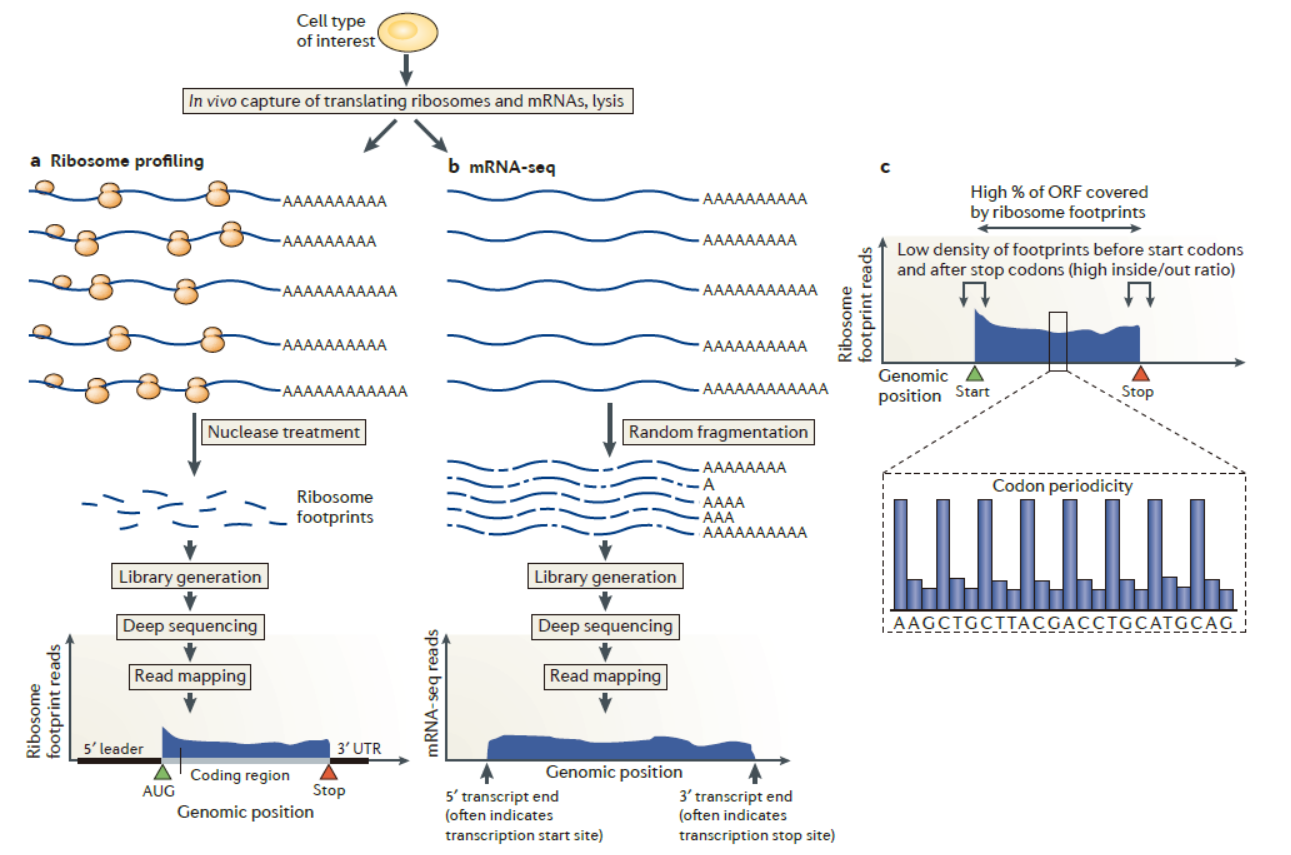
图1 Ribosome Profiling示意图 ([2])
本文采用的也是这一技术流程,共收集了65例扩张性心肌病(DCM)患者左心室心肌组织和15例正常对照者的左心室心肌组织。Ribosome Profiling测序结合全转录组测序(Transcriptome),分析了DCM与健康对照组被翻译的RNA分子总体情况,结合之前一项心脏组织蛋白质组学的数据([3]),系统分析了左心室心肌组织中被翻译的ORF和对应的蛋白或多肽的总体信息。共发现1090个uORF(来自919个基因),20763个传统的ORF(来自11102个基因),74个dORF(来自62个基因)。还包括了339个sORF(来自于169个lncRNA)。
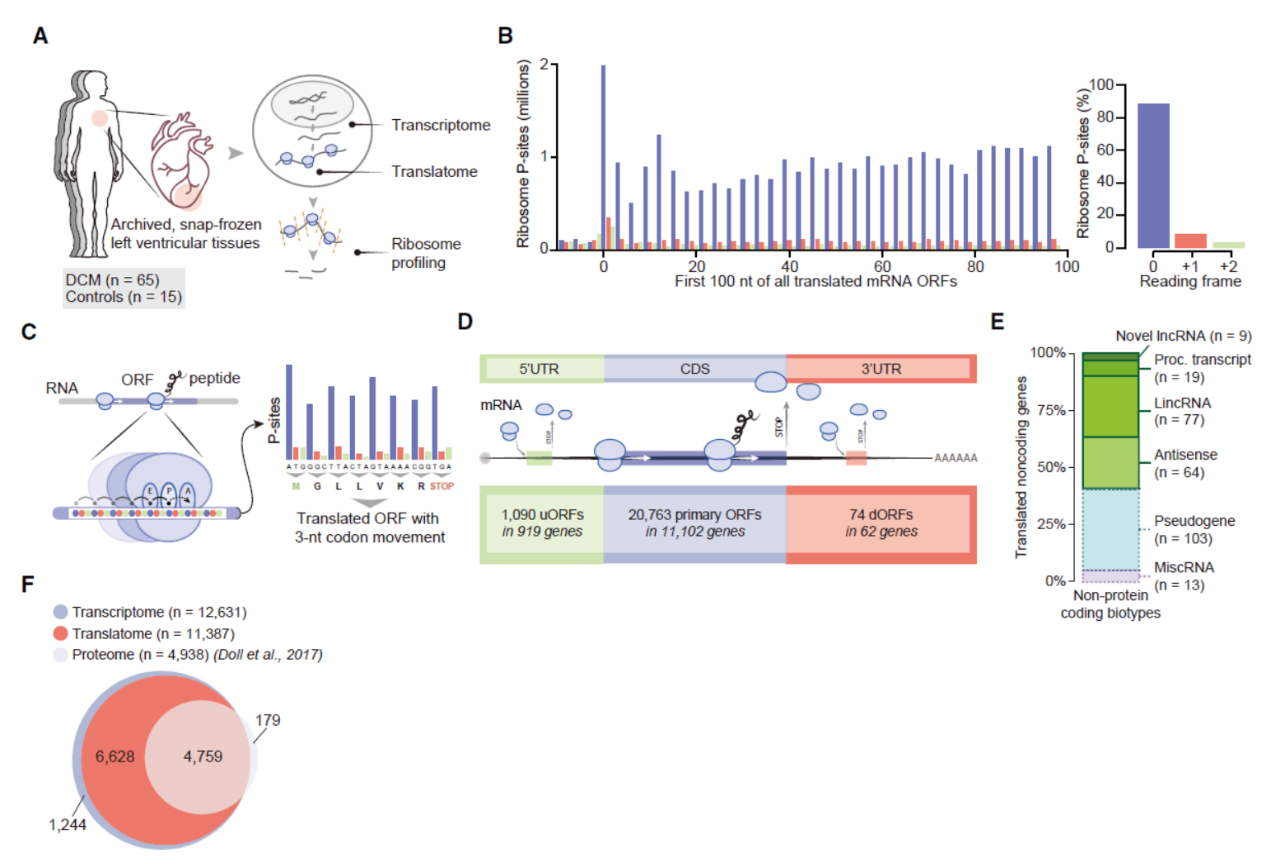
图2 心脏翻译组学研究概览 ([1])
作者如何发现circRNA被翻译的?
由于circRNA与来源的母基因序列高度一致,只有接口位置有所差别,这给分析翻译的circRNA带来极大困难和挑战。只有当核糖体恰好处在接口位置并被Ribosome Profiling实验捕获的才被认为是可能被翻译的circRNA。本文作者也是通过分析被核糖体捕获的circRNA接口序列得到可翻译的circRNA信息。一共找到了40个可翻译的circRNA分子。作者分析接口位置Reads的条件是不少于9nt的跨接口碱基,在不少于3个样本且总Reads数不少于5个的才算有效的可翻译circRNA。
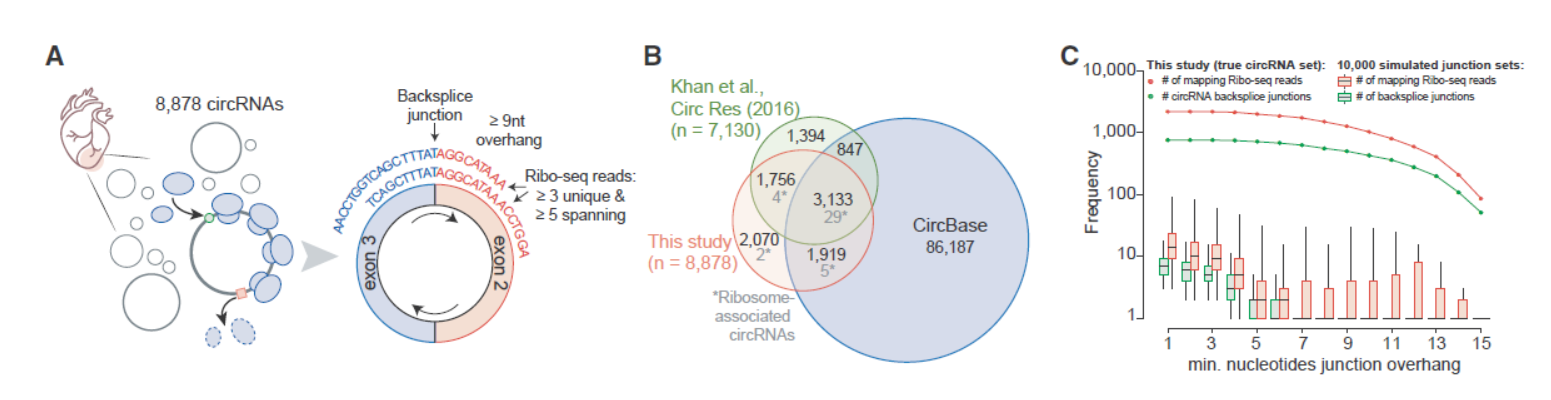
图3 Ribosome Profiling分析可翻译的circRNA ([1])
本文发现的被翻译的circRNA有哪些?
这40个circRNA来自39个基因,其中有6个circRNA的翻译产物在早期的蛋白质组学研究中有对应的质谱线索。40个circRNA中也不乏大家耳熟能详的明星分子,包括CDR1as等等。其中circCFLAR,circSLC8A1,circMYBPC3和circRYR2是首次发现的心肌中可被翻译的circRNA分子。
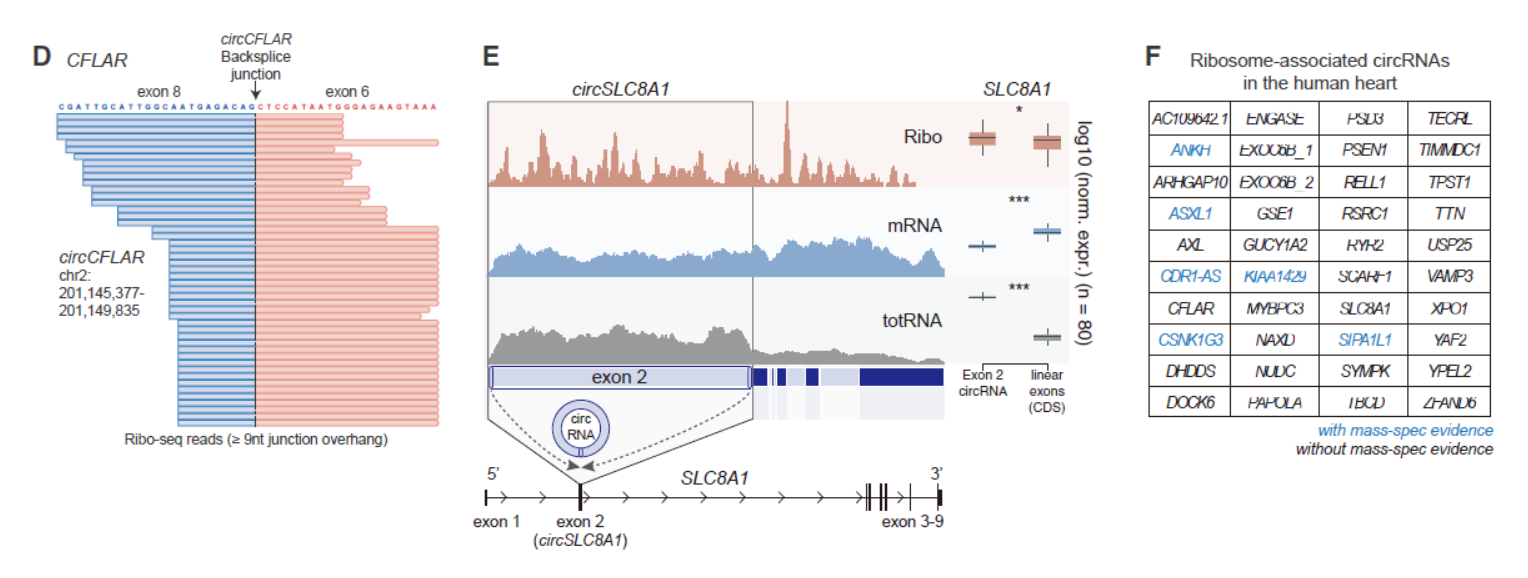
图4 心肌中可翻译的circRNA ([1])
心脏中存在显著的蛋白翻译效率调控机制
整合全转录组和翻译组的数据后分析表明心脏组织中存在明显的翻译水平的调控作用,数据整理后相关的基因做通路富集,结果表明ECM,mTOR,Sarcomere等相关的通路受到较明显的翻译效率调控。
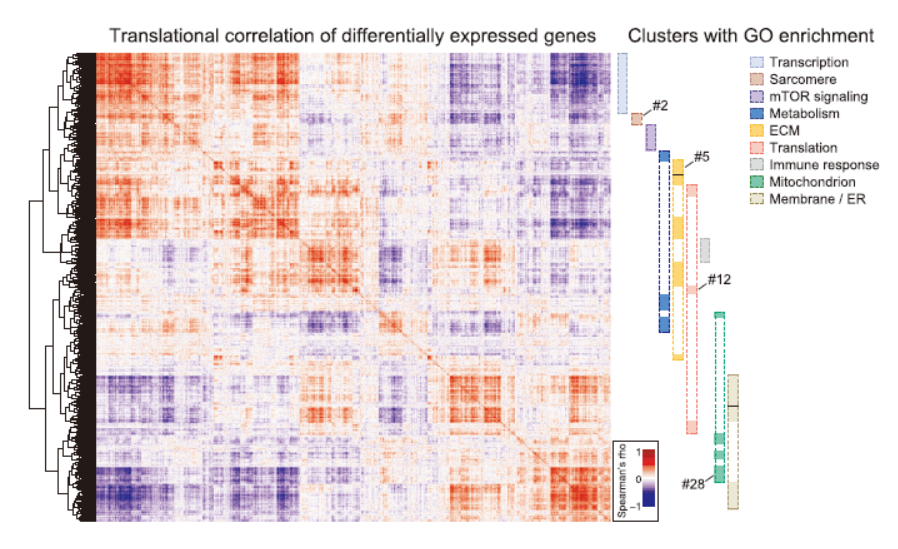
图5 心脏存在翻译效率调控机制 ([1])
除了常规ORF区,在本文的研究中还发现了位于上游区的uORF和下游的dORF也可被翻译。研究中共发现了来自919个基因的1090个uORF,DCM的uORF翻译效率总体高于对照组,暗示可能存在疾病特异性的uORF翻译调控作用。
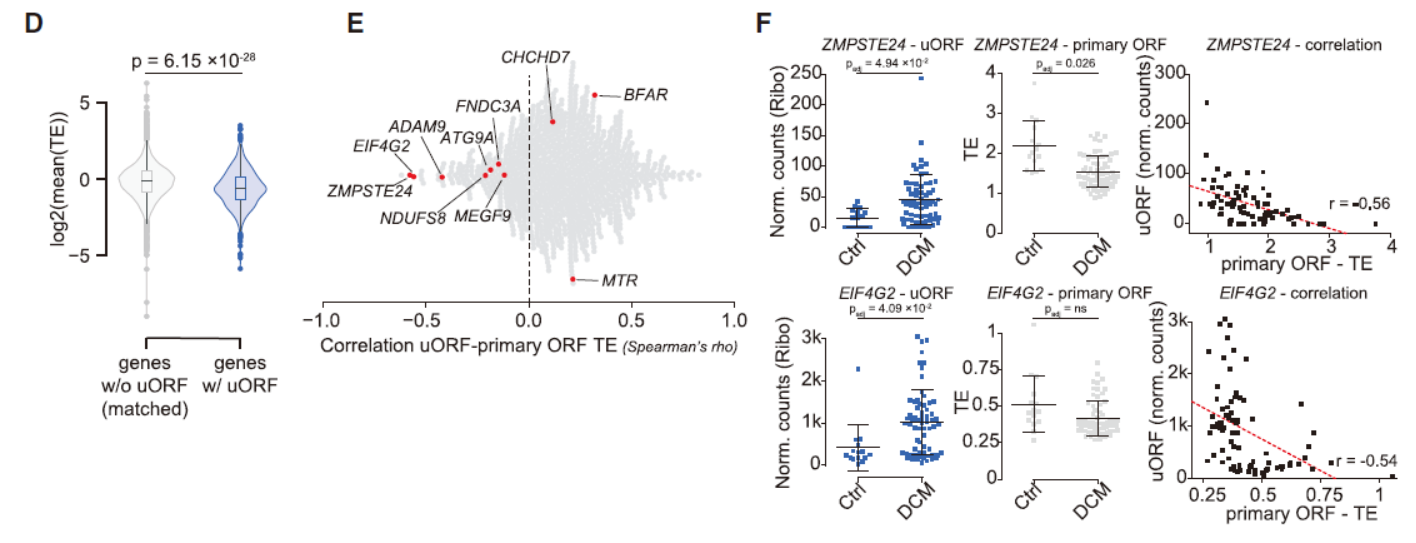
图6 心脏中uORF翻译分析 ([1])
lncRNA中sORF翻译状态分析
一些长链非编码RNA可被翻译已经是大家熟知的现象了,本文的研究中也发现了一批lncRNA中的sORF。为验证这些sORF翻译的真实性,作者采用了麦胚提取物体外翻译体系进行验证,待测分子分别构建野生型和AUG突变型的RNA,体外转录后纯化,然后用麦胚提取物进行体外翻译,用放射性35S-Met掺入法检测被翻译的情况,电泳后曝光分析对应分子量范围内差异条带,最终验证了多种lncRNA中的sORF可以被翻译。此外,作者还分析了小鼠和大鼠中对应的lncRNA是否被翻译。其中Linc-PINT在此前就曾报道可通过形成circRNA而被翻译[4],在这个研究中表明线性的linc-PINT也能被翻译。
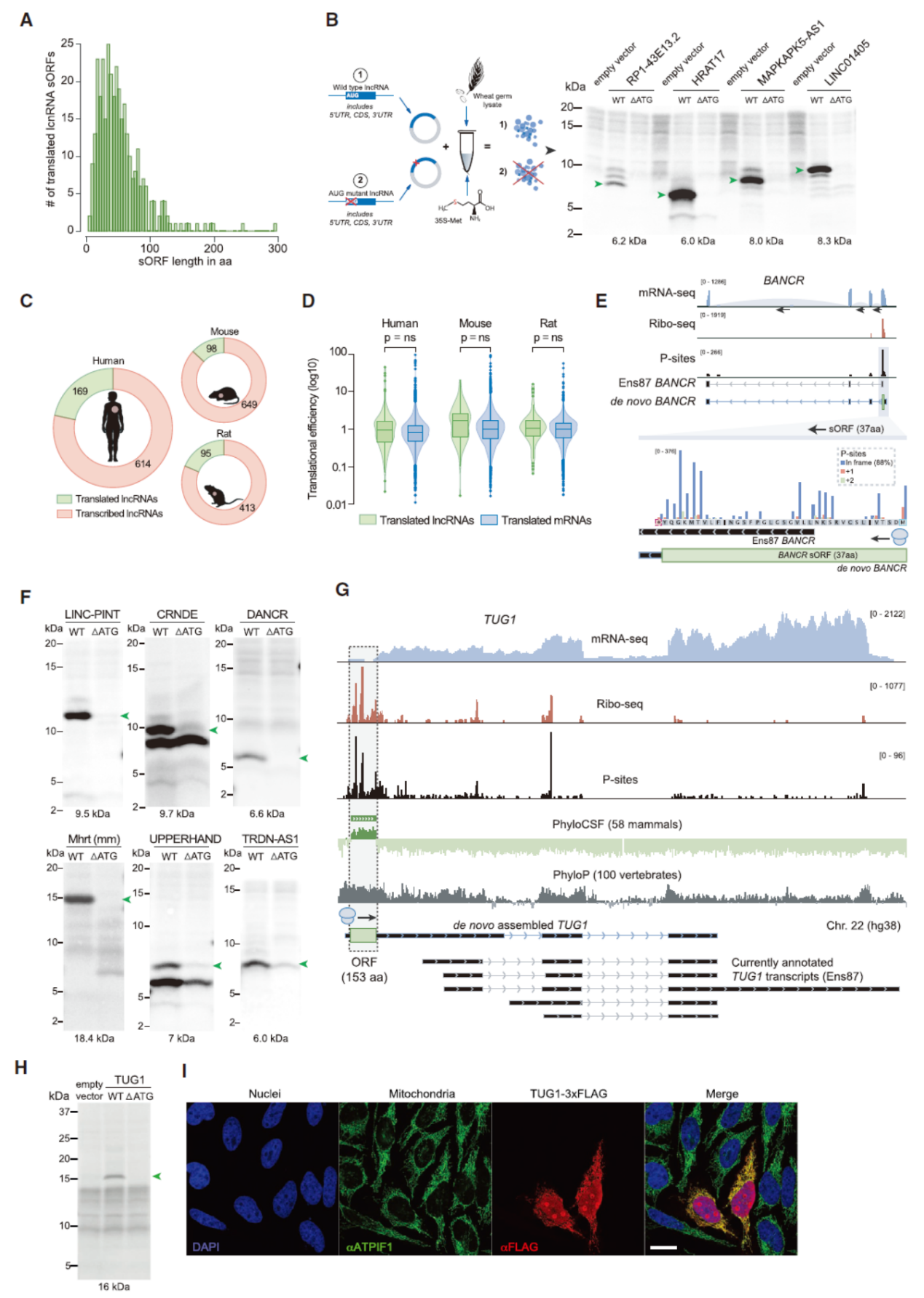
图7 心脏中可翻译的lncRNA分析 ([1])
这些由lncRNA编码的多肽中,有一部分具有典型的线粒体定位信号,因此作者抽出这一部分进行专门分析。共表达分析锁定了其中的一部分可翻译的lncRNA,挑选了三个lncRNA的sORF进行Flag融合后免疫荧光验证,结果证实人为过表达的多肽的确有很强的线粒体定位。

图8 线粒体定位的lncRNA编码小肽分析 ([1])
本文是一项工作量巨大的心脏组织翻译组学研究项目,提供了很多非常有价值的信息,也再次有力的证明了circRNA可以被翻译。这些有趣的翻译产物的功能研究基本是一片空白,未来可以成为非常有价值的研究对象。
参考文献
1. Sebastiaan van Heesch, F.W., …,Norbert Hubner, The Translational Landscape of the Human Heart. Cell, 2019.
2. Brar, G.A. and J.S. Weissman, Ribosome profiling reveals the what, when, where and how of protein synthesis. Nat Rev Mol Cell Biol, 2015. 16(11): p. 651-64.
3. Doll, S., et al., Region and cell-type resolved quantitative proteomic map of the human heart. Nat Commun, 2017. 8(1): p. 1469.
4. Maolei Zhang, K.Z., Xiaoping Xu, et al., A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma. Nature Communications, 2018.
.png)