近期Nature和Cell连续两天分别发表了关于染色体外环状DNA(extrachromosomal circular DNA, eccDNA)的研究论文,将eccDNA推向了新的高度,eccDNA也瞬间变成了“网红”。那么eccDNA到底是什么呢?是新发现吗?为什么会这么受关注?这种分子有什么主要特征?怎么研究它呢?大家一定都在思考这些问题。笔者也带着好奇详细检索调研了eccDNA的研究历史,汇总之后跟大家在此分享。由于内容比较多,我们将分成四期分别介绍eccDNA的研究历史,主要特征,肿瘤中的作用及研究方法。


eccDNA的发现历史
环状DNA是自然界普遍存在的一种DNA分子形式,比如大家熟悉的细菌或酵母等微生物的基因组DNA,质粒等等都是环状DNA分子,此外一些特殊的遗传信息传递元件也是以环状DNA的形式存在和发挥作用,如转座子DNA,Integrons等等([1])。除了低等生物,在高等真核生物中也大量存在环状DNA分子,它们大小不一,来源和功能也差别较大。
人类有23对染色体(Chromosome),携带了全部的基因组信息,在正常细胞增殖分裂过程中通过DNA复制和有丝分裂实现遗传信息的稳定复制和传递。染色体外DNA游离于染色体基因组DNA外,是一类特殊的遗传物质,它们有些是从染色体中脱落或分离出来的,有些则是完全独立的遗传物质。常见的人类染色体外DNA包括线粒体DNA(mitochondrial DNA, mtDNA),小分散环状DNA(small polydispersed circular DNA,spcDNA),B-细胞或T-细胞成熟中形成的小环状DNA,端粒序列形成的小环状DNA分子,Episomes,迷你染色体(minichromosomes),双微体(double minute chromosomes,DM)等等([2])。线粒体DNA是重要的染色体外遗传物质,在几乎所有的细胞类型中均存在。spcDNA,B-细胞或T-细胞成熟中形成的小环状DNA及端粒序列的小环状DNA一般分子量非常小,不携带完整的基因信息,但Episomes,迷你染色体和双微体一般比较大,可以携带完整的基因,迷你染色体还携带着丝粒和端粒。Episomes和双微体没有着丝粒和端粒结构,现在认为Episomes可能是双微体的前体形式([1])。这些染色体外DNA也在绝大部分的人类细胞类型中存在,它们在生命活动过程中发挥了重要功能,在衰老和肿瘤等病理变化过程中也发挥了特殊的作用([1])。
目前认为eccDNA是指基因组DNA来源的染色体外不携带着丝粒和端粒的游离环状DNA分子。eccDNA可携带完整的基因,大小在1~3Mb左右,在光学显微镜中就能进行观察([3])。上述的Episomes,双微体都属于eccDNA的范畴,在本文中如果没有特指,所有的eccDNA均指这一类的染色体外DNA分子。eccDNA的序列是正常基因组DNA的一段,但它们不再留在上述的23条染色体中,而是游离在它们之外,因此称为染色体外DNA。在肿瘤等疾病中,会出现基因组不稳定的情况,表现为有些基因会丢失,有的基因却被扩增,有些本来不在同一个染色体的基因却融合在一起的情况,或者染色体总数目不再是23对,有的染色体变多了,有的则可能丢失了一部分等等。染色体不稳定性是一些恶性肿瘤的重要特征,在肿瘤的发生发展过程中起重要作用,eccDNA也是肿瘤基因组不稳定的一种形式,因此这方面的研究备受关注。
早在1965年,Hotta, Y.等就从麦胚和猪精子中发现了染色体外环状DNA分子([4]),也是在同一年,Cox, D.等报道从人的肿瘤标本细胞中发现了染色体外的DNA分子,它们具体经常是成对出现的,因此当时称其为双微体(double-minutes)([5])。这是首次在人类肿瘤中观察到染色体体外游离的DNA分子。此后多项研究发现双微体可携带癌基因,包括EGFR和c-Myc等等([1])。多项研究也表明这种染色体外DNA分子常以环状DNA的形式存在([6-9]),进一步的研究发现人类染色体外DNA其实只有大约30%的是以双微体的形式存在的([3]),因此上面提到的双微体概念渐渐被染色体外环状DNA(extrachromosomal circular DNA, eccDNA)的表述替代了。

图1 人类肿瘤细胞中存在双微体(eccDNA)([5])
上世纪60和70年代主要集中在发现各种类型染色体外DNA分子的阶段,80年代前后,随着分子克隆等技术的发展成熟,关于双微体的功能机制研究也陆续展开。1978年,Alt, F. W.等报道发现氨甲喋呤耐药的小鼠细胞存在携带DHFR基因的双微体,这些双微体的存在导致了DHFR基因的扩增,介导了小鼠细胞对氨甲喋呤的耐药([10])。这是首次报道双微体(eccDNA)的作用机制。随后,1983年,Kohl, N. E.报道神经母细胞瘤中存在携带MYCN的双微体([11])。与此同时,Alitalo, K.等报道结肠癌细胞的双微体中携带了c-Myc基因([12])。随后有多项研究发现药物等刺激处理会促进形成双微体([3])。此外,这段时期还对双微体DNA的复制机制进行了探索研究, Ruiz, J. C.等发现双微体DNA复制机制与基因组DNA的复制机制是一样的,对双微体DNA的复制过程有了深入的了解([13])。
近期,随着芯片微阵列分析和二代测序技术的发展成熟,基于高通量序列分析的新兴技术为研究eccDNA提供了强有力的工具,大大推进了这方面的发展。2012年,Shibata, Y.等报道从小鼠和人的细胞中发现了一类小的染色体外环状DNA分子,它们大小在200-400bp不等,它们倾向于从基因的5’UTR,外显子和CpG岛位置形成([14]),但这种染色体外环状DNA与eccDNA不太一样,文章称其为microDNA。2014年, Paul S. Mischel团队发现胶质瘤细胞中存在携带EGFRvIII突变型基因的eccDNA,介导了EGFR抑制剂耐药([15])。2017年,Paul S. Mischel团队对17种肿瘤的2572种细胞系的全基因组测序分析,发现超过一半的人类肿瘤中存在eccDNA,这些eccDNA分子经常携带肿瘤驱动基因([16])。2018年,Moller, H. D.等报道从健康人的肌肉和血液细胞中分离到超过十万种的eccDNA分子,它们绝大部分都携带基因或基因的片段,长度往往小于25kb([17])。这一报道表明eccDNA可能是普遍存在的分子。2019年,Paul S. Mischel团队报道eccDNA存在显著的染色体开放状态和更远距离相互作用的形式,提高了对eccDNA的作用机制认识([18])。另一篇文章中,Andrew R. Morton等对eccDNA中染色质结构和增强子状态进行了分析,表明eccDNA中非编码区的增强子功能也在eccDNA所携带的癌基因表达调控中发挥功能,也进一步表明了eccDNA特殊的染色质结构及其功能([18])。
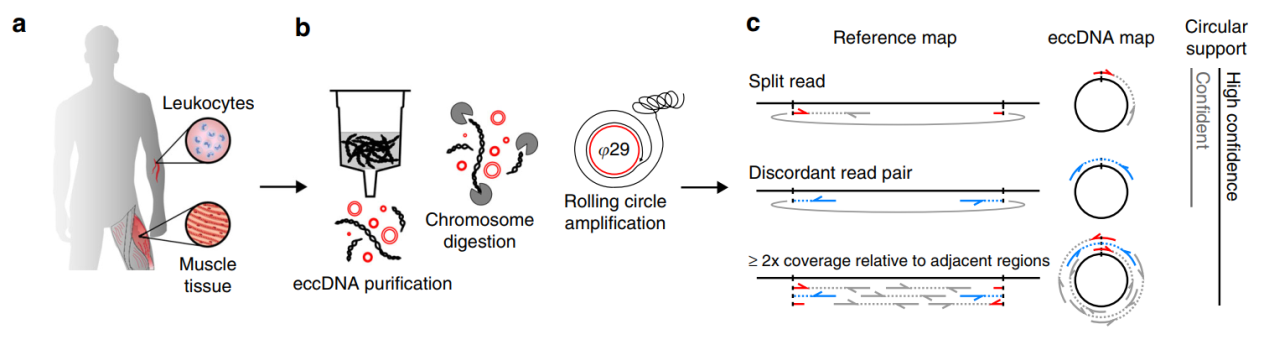
图2 人的肌肉和血液组织含有大量环状DNA ([17])
eccDNA虽然很早就发现和报道了,但只有到近期通过结合各种高通量测序技术之后才对它们进行了深入的分析研究,目前还有很多重要的科学问题没有得到很好的解答,包括eccDNA的形成机制,是否存在形成eccDNA的拼接热点?eccDNA对基因组DNA的影响和调控方式,eccDNA是否存在细胞间传递机制?肿瘤发生发展过程中eccDNA如何实现富集或丢失的?等等,相信随着研究工作的不断推进,这些问题可以陆续得到解答。
参考文献
1. Barreto, S.C., M. Uppalapati, and A. Ray, Small Circular DNAs in Human Pathology. Malays J Med Sci, 2014. 21(3): p. 4-18.
2. Kuttler, F. and S. Mai, Formation of non-random extrachromosomal elements during development, differentiation and oncogenesis. Semin Cancer Biol, 2007. 17(1): p. 56-64.
3. Verhaak, R.G.W., V. Bafna, and P.S. Mischel, Extrachromosomal oncogene amplification in tumour pathogenesis and evolution. Nat Rev Cancer, 2019. 19(5): p. 283-288.
4. Hotta, Y. and A. Bassel, Molecular Size and Circularity of DNA in Cells of Mammals and Higher Plants. Proc Natl Acad Sci U S A, 1965. 53: p. 356-62.
5. Cox, D., C. Yuncken, and A.I. Spriggs, Minute Chromatin Bodies in Malignant Tumours of Childhood. Lancet, 1965. 1(7402): p. 55-8.
6. Schimke, R.T., Gene amplification in cultured animal cells. Cell, 1984. 37(3): p. 705-13.
7. Schimke, R.T., Gene amplification and methotrexate resistance in cultured animal cells. Harvey Lect, 1980. 76: p. 1-25.
8. Stark, G.R., et al., Recent progress in understanding mechanisms of mammalian DNA amplification. Cell, 1989. 57(6): p. 901-8.
9. Fan, Y., et al., Frequency of double minute chromosomes and combined cytogenetic abnormalities and their characteristics. J Appl Genet, 2011. 52(1): p. 53-9.
10. Alt, F.W., et al., Selective multiplication of dihydrofolate reductase genes in methotrexate-resistant variants of cultured murine cells. J Biol Chem, 1978. 253(5): p. 1357-70.
11. Kohl, N.E., et al., Transposition and amplification of oncogene-related sequences in human neuroblastomas. Cell, 1983. 35(2 Pt 1): p. 359-67.
12. Alitalo, K., et al., Homogeneously staining chromosomal regions contain amplified copies of an abundantly expressed cellular oncogene (c-myc) in malignant neuroendocrine cells from a human colon carcinoma. Proc Natl Acad Sci U S A, 1983. 80(6): p. 1707-11.
13. Ruiz, J.C., et al., Autonomously replicating episomes contain mdr1 genes in a multidrug-resistant human cell line. Mol Cell Biol, 1989. 9(1): p. 109-15.
14. Shibata, Y., et al., Extrachromosomal microDNAs and chromosomal microdeletions in normal tissues. Science, 2012. 336(6077): p. 82-6.
15. Nathanson, D.A., et al., Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA. Science, 2014. 343(6166): p. 72-6.
16. Turner, K.M., et al., Extrachromosomal oncogene amplification drives tumour evolution and genetic heterogeneity. Nature, 2017. 543(7643): p. 122-125.
17. Moller, H.D., et al., Circular DNA elements of chromosomal origin are common in healthy human somatic tissue. Nat Commun, 2018. 9(1): p. 1069.
18. Wu, S., et al., Circular ecDNA promotes accessible chromatin and high oncogene expression. Nature, 2019.
.png)