1. circRNA基本生命科学问题研究进展
1.1 circRNA能直接翻译多肽
1.2 circRNA组织/疾病特异性表达机制与功能研究进展
1.3 circRNA参与生理活动功能机制研究
1.4 circRNA存在m6A修饰
1.5 其他circRNA基础生命科学问题研究报道汇总
2018年已经到来,首先恭祝各位同仁新年快乐,预祝新的一年里大家能有更好的成果,生活幸福,身体健康!
在刚刚过去的2017年里,circRNA领域有一系列激动人心的经历,包括首次证明circRNA可以直接翻译多肽,首次发现circRNA存在m6A修饰等等。2017年是circRNA研究的丰收年,不仅在circRNA相关的基础生命科学问题的方面的重大进展,还在相关疾病的机制研究,信息学和数据库工具,涉及的学科领域方面都有巨大的进步。2017年国家自然科学基金也捷报频传,杰出青年基金,优秀青年基金,重点项目等都有斩获,总受理数量高达176项!实现了三连升。为方便同行回顾相关进展,山人借此机会给大家梳理了一下2017年度circRNA的主要研究进展,由于涉及的论文体量巨大,面面俱到不太现实,就抽取了有代表性的方向和进展,其余的以列表的方式总结在相关分目录的后面,以方便大家查阅。
1. circRNA基本生命科学问题研究进展
circRNA是生命遗传信息传递和发挥作用过程中一个非常奇特的产物,目前的研究表明circRNA也是服从中心法则的,但与传统的核酸分子又有巨大的差别。主要表现在没有游离的末端,由此导致了circRNA具有不同于传统线性核酸分子的独特结构和功能。正因如此,关于circRNA如何形成和发挥作用的问题吸引了众多国内外研究者的好奇心。circRNA有关的基本生命科学问题的每一个进展也格外激动人心。2017年有关circRNA的基本生命科学问题取得了巨大的进展,主要体现在首次证明circRNA具有翻译潜能,首次报答发现circRNA也具有m6A修饰,与此同时,关于组织/疾病/生理活动特异性的circRNA表达机制和功能机制也取得了长足进步。下面就让我们一起回顾一下吧:
1.1 circRNA能直接翻译多肽
一直以来,circRNA被认为是一种非编码RNA,但这一认识在2017年被打破了,先后有4篇研究论文报道发现并证实了circRNA可以翻译多肽,这无疑是2017年度circRNA研究领域最重要的进展之一,Science,Nature等知名杂志也对此做过专门的评论。
circRNA存在m6A修饰,并且该修饰能促进circRNA翻译:
3月10日,Cell Research杂志在线发表了中科院上海计算生物学研究所王泽峰教授为通讯作者的研究论文,介绍发现了circRNA中m6A修饰,并且该修饰能促进circRNA翻译[1]。

在本文中,王教授给出的m6A修饰调控circRNA翻译的机制是:由METTL3/METTL14-WTAP蛋白复合物进行m6A修饰,FTO进行m6A去修饰调控。含有m6A修饰的位点通过募集YTHDF3进而募集eIF4G2,进而启动蛋白翻译过程。该论文具有里程碑式的重要意义,首先证明了circRNA可进行翻译活动,其次,还是首次报道circRNA存在m6A修饰,填补了circRNA化学修饰方式研究的空白[1]。
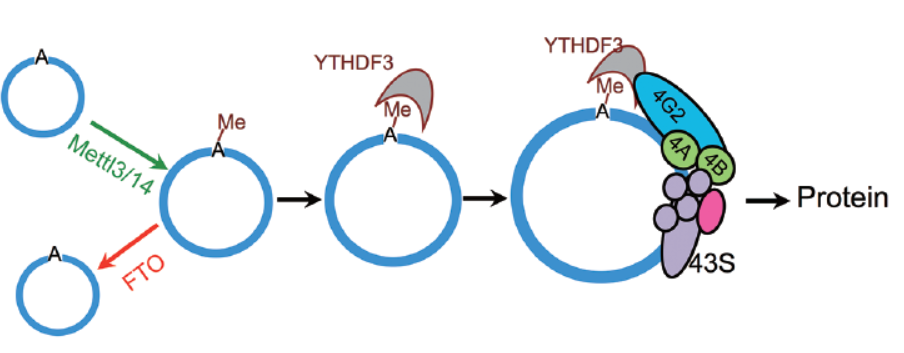
图1 m6A修饰调控circRNA翻译(来自[1])
circ-FBXW7可翻译蛋白并在胶质瘤中发挥重要作用
8月29日,JNCI杂志在线发表了中山大学附属第一医院张弩副教授为通讯作者的文章,介绍发现circ-FBXW7可以翻译一种抑制胶质瘤的全新蛋白质[2]。

文章报道发现circ-FBXW7可直接翻译蛋白FBXW7-185aa,与母基因编码的FBXW7蛋白协同调控c-Myc的稳定性,抑制恶性胶质瘤的发生进展。本项发现首次证明circRNA所翻译的蛋白与母基因的蛋白表达产物协同作用,共同发挥功能[2]。该研究再次打破了科学界以往将circRNA看作“非编码RNA”的传统认识,进一步拓展了circRNA的研究思路,对circRNA功能研究具有极高的参考价值。
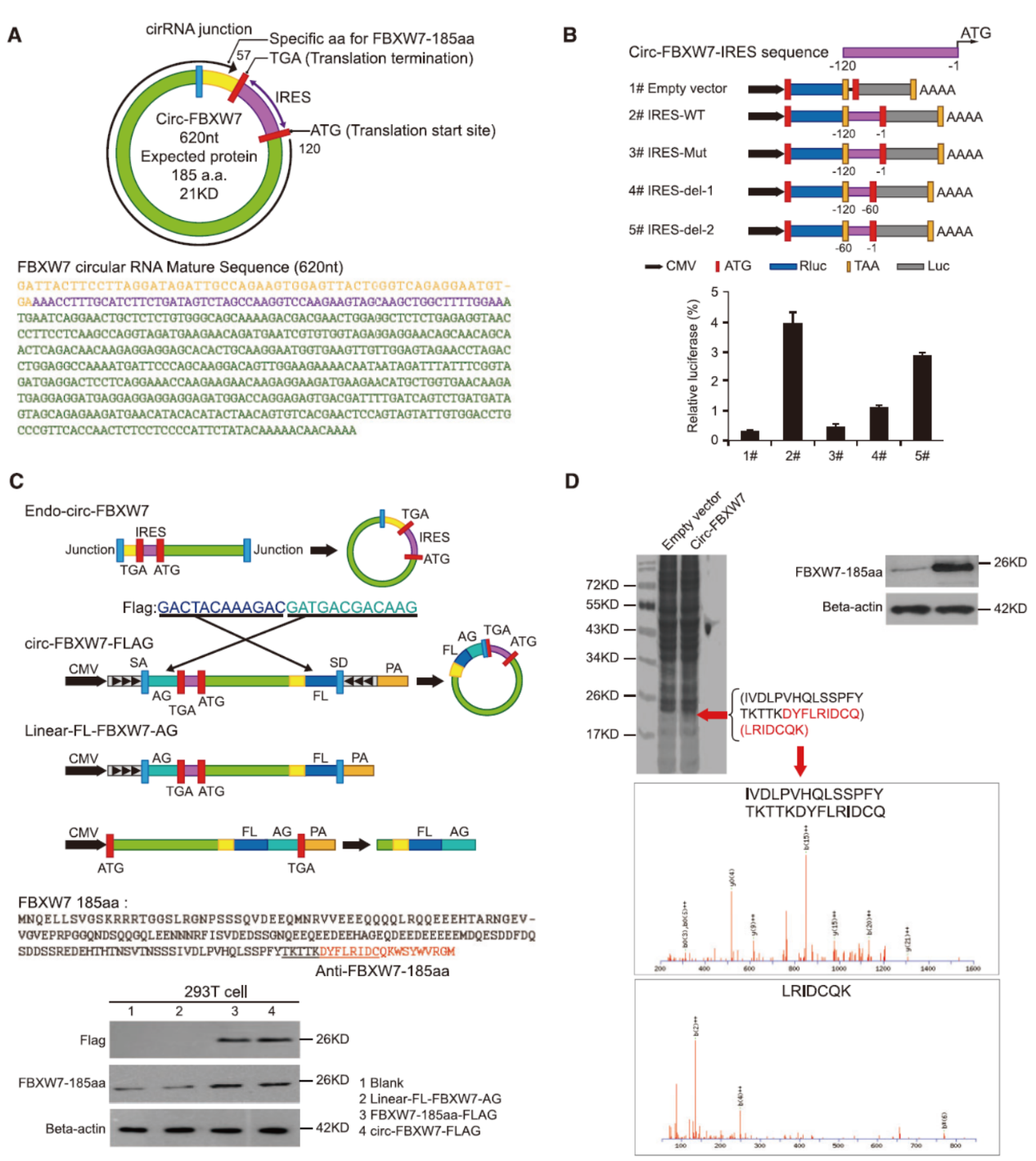
图2 circ-FBXW7可直接翻译蛋白(来自[2])
Molecular Cell文章介绍发现circRNA可翻译蛋白
3月15日,Molecular Cell在线发表了以色列希伯来大学的Sebastian Kadener教授,介绍基于果蝇大脑中核糖体印迹分析(ribosome footprinting)发现大量的circRNA翻译蛋白或多肽的情况[3]。

作者在果蝇的大脑组织中进行核糖体印迹分析,发现了有些circRNA可以结合到核糖体上,于是作者认为circRNA有可能具有翻译蛋白的功能。经过一系列的严谨实验论证,作者得出结论:部分circRNA可翻译蛋白。核糖体印迹分析中证明circMbl中的终止密码子处有核糖体结合。circMbl所编码的蛋白在蛋白质谱中得到证据[3]。
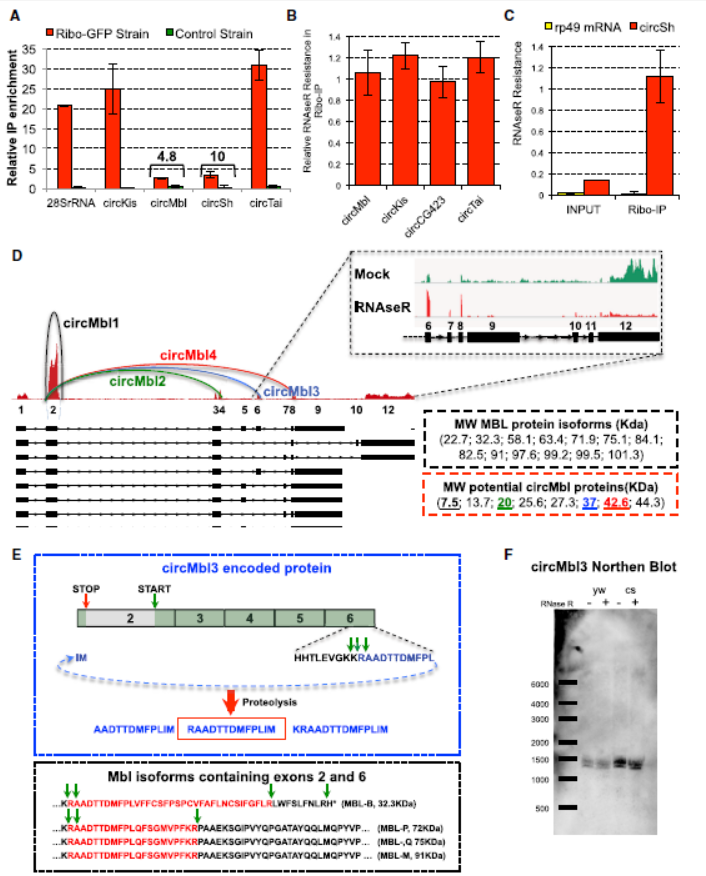
图3果蝇CircMbl可翻译蛋白 (来自[3])
Circ-ZNF609可直接翻译蛋白并参与肌肉发生过程
3月16日,Molecular Cell杂志在线发表了意大利罗马萨皮安扎大学Irene Bozzoni教授,介绍发现了circRNA Circ-ZNF609可直接翻译蛋白,该蛋白参与肌肉发生过程[4]。

文中作者首先筛选与肌肉发生有关的circRNA,人和小鼠中都进行了筛选,还选择了杜氏肌营养不良疾病模型一并进行筛选。最终筛选到一批特征性的circRNA,接着,作者又针对这些circRNA进行了RNAi文库筛选,以找出对肌肉发生功能有关的circRNA。基于这一系列的筛选,作者最终发现了Circ-ZNF609。接下来针对Circ-ZNF609的功能研究作者验证了其翻译多肽的功能,并针对该功能进行了一系列的生化验证实验[4]。
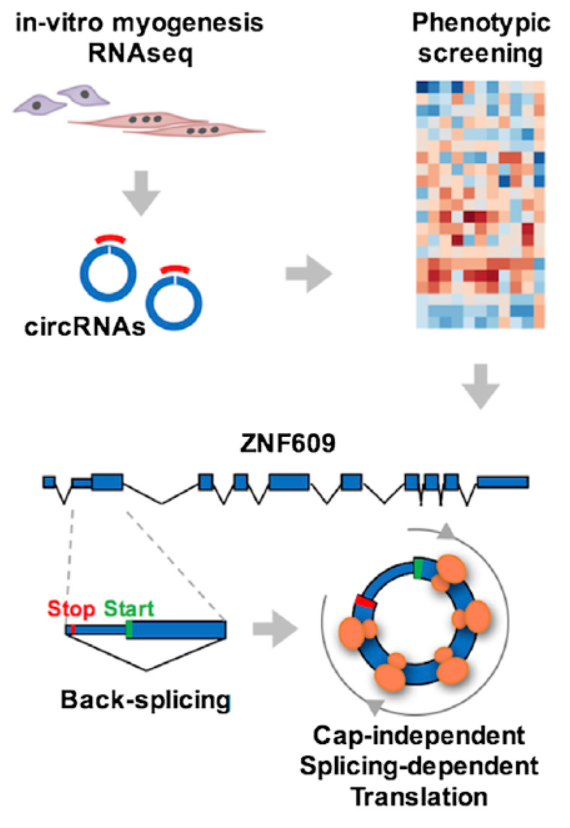
图4 circ-ZNF609可直接翻译蛋白并参与肌肉发生过程(来自[4])
1.2 circRNA组织/疾病特异性表达机制与功能研究进展
大量研究表明circRNA存在组织/疾病特异性的表达特征,形成机制还不完全清楚。2017年有多篇文献报道揭示了一些组织/疾病特异性的circRNA形成机制。
Naure报道:RNA解旋酶DHX9特异性结合反向Alu元件调控RNA加工和circRNA形成
3月29日,Nature杂志在线发表了德国马普学会免疫生物学和表观遗传学研究所Asifa Akhtar教授为通讯作者的Letter文章,介绍发现反向Alu元件通过RNA解旋酶DHX9调控RNA转录后加工过程。DHX9缺失会导致circRNA增多,为反向Alu元件调控RNA转录产物加工过程提供了全新的机制模型[5]。

人类基因组含有大量的转座性元件,其中包括以Alu元件为代表的短散在序列(SINE),约占到了人类基因组的10%左右的体量。在这篇文章中,作者发现RNA解旋酶DHX9特异性识别反向重复Alu元件。DHX9缺失会导致RNA转录后剪接异常,circRNA增多[5]。
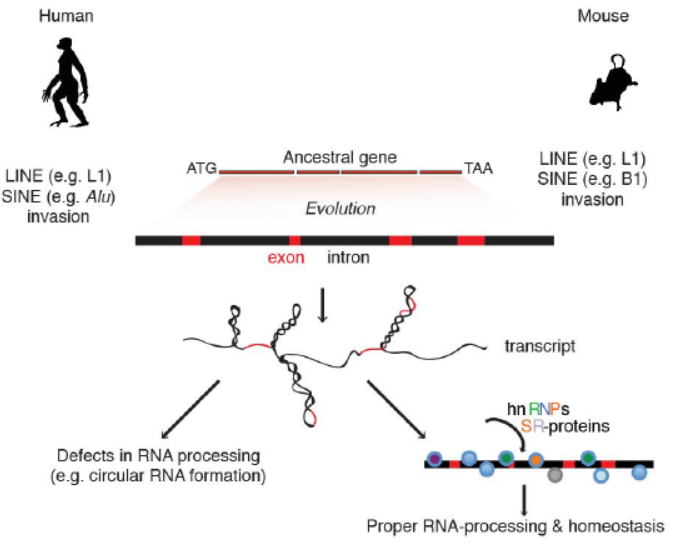
图5 DHX9特异性结合反向互补Alu元件调控RNA加工与circRNA形成(来自[5])
Molecular Cell杂志发表circRNA形成机制重要文章
11月22日,Molecular Cell杂志在线发表了宾夕法尼亚大学佩雷尔曼医学院Jeremy E. Wilusz教授为通讯作者的文章,介绍发现circRNA形成调控的新机制,杨力教授和陈玲玲教授为本文的共同作者。

研究circRNA的同行一定会注意到这个现象:同一个基因来源的linear RNA与circRNA的含量有时有相同的对应关系,有时却恰恰相反。本文作者的初衷正是希望找出决定linear RNA与circRNA相对量的机制。基于RNAi筛选,作者利用果蝇细胞中构建的Mini基因报告系统,发现了剪切体组分及转录终止相关的基因被干扰之后能显著增加circRNA的丰度,并进一步在体内和体外验证了相关的现象[6]。本文的发现为circRNA形成的调控机制提供了非常有价值的信息。
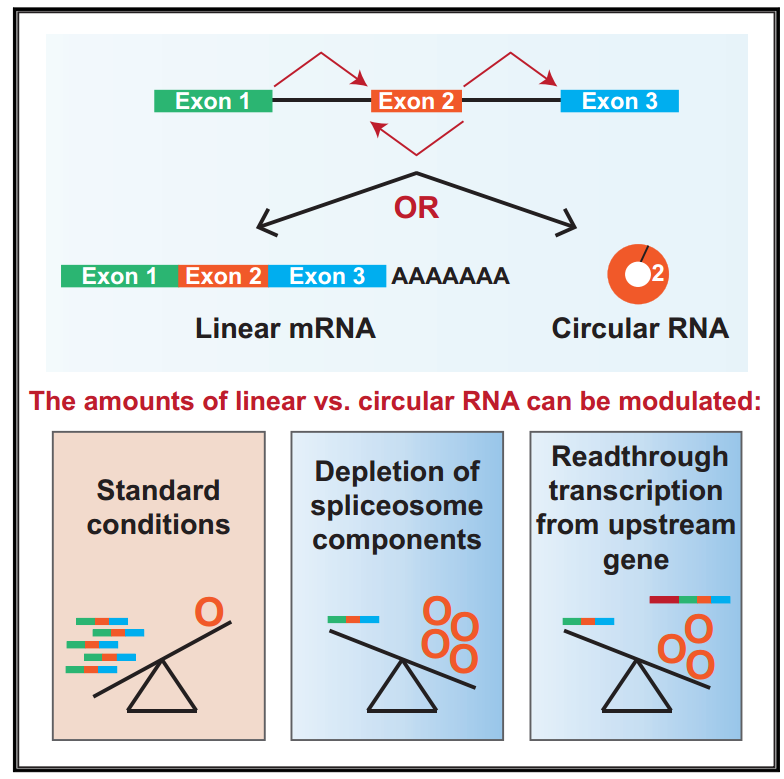
图6 剪接异常或转录通读促进circRNA形成(来自[6])
NF90/NF110通过促进内含子互补序列稳定性促进circRNA形成
6月15日,Cell子刊Molecular Cell杂志在线发表了陈玲玲教授和杨力教授为共同通讯作者的文章,报道发现病毒感染相关因子NF90/NF110通过促进内含子互补序列稳定性促进circRNA形成[7]。

本文主要报道发现了病毒感染相关的因子NF90/NF110参与circRNA的形成过程。是通过RNA干扰文库筛选鉴定出来的,NF90/NF110通过稳定内含子互补序列结构促进circRNA的形成。病毒感染的条件下,诱导NF90/NF110出核并抑制病毒复制,circRNA生成量也随之降低[7]。
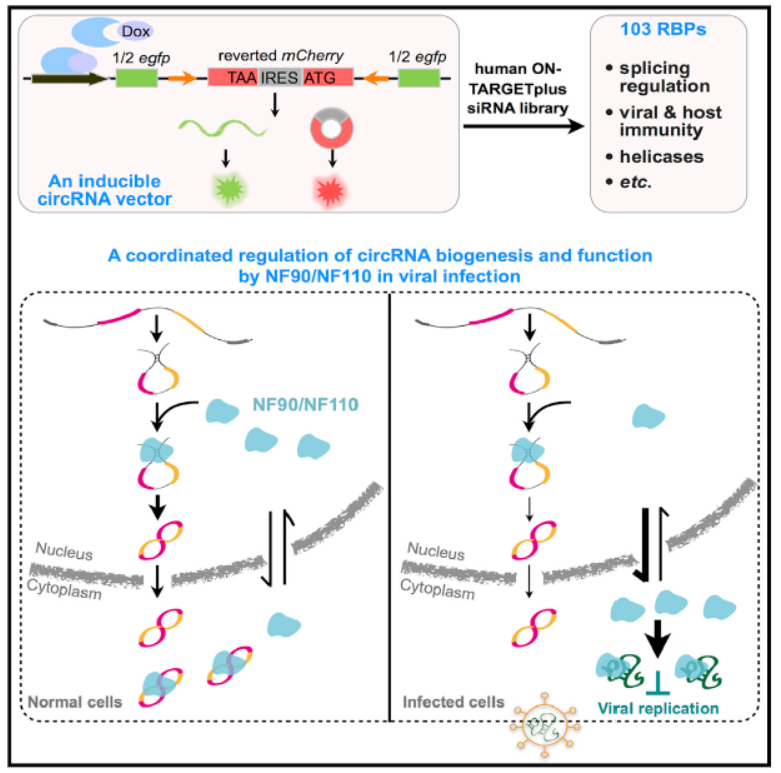
图7 病毒感染相关因子NF90/NF110调控circRNA形成(来自[7])
RNA结合蛋白FUS调控神经元circRNA形成
3月30日,Nature Communication杂志在线发表了罗马萨皮安扎大学Mariangela Morlando教授和意大利技术研究所Irene Bozzoni教授为共同通讯作者的文章,介绍发现RNA结合蛋白FUS在神经元中介导RNA反向拼接活动,与circRNA的形成有关[8]。

文中作者首先比较了FUS基因敲除前后自ES分化的运动神经元中circRNA的表达状况,发现FUS敲除后有一批circRNA的表达明显降低。接着基于RNA干扰和过表达ALS疾病相关的FUS基因后circRNA的表达变化情况,最终明确了FUS蛋白在神经元中调控了RNA反向拼接的作用,与circRNA的形成有关[8]。
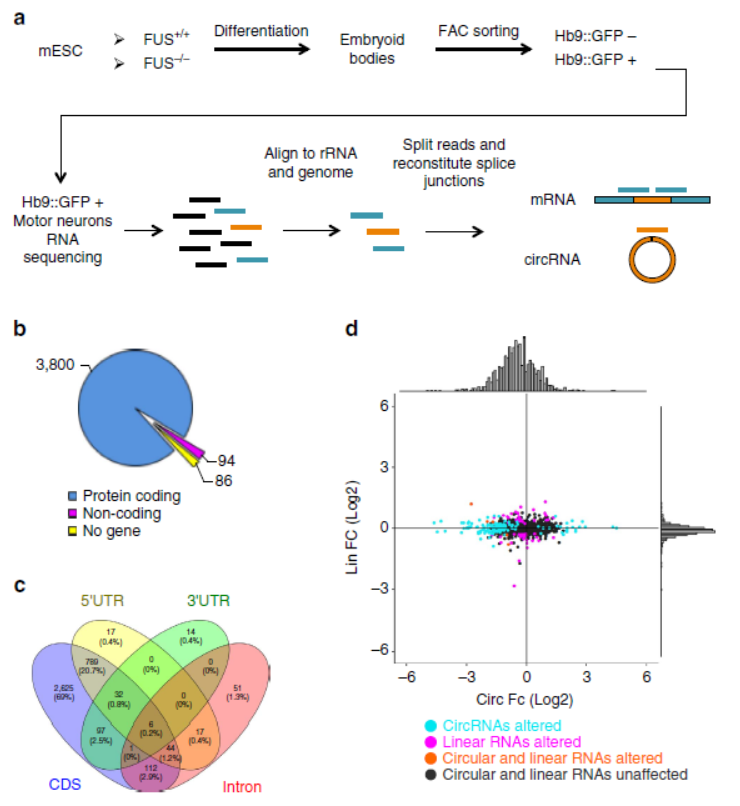
图8 FUS敲除对运动神经元circRNA的影响(来自[8])
HNRNPL调控可变剪切和circRNA生成
6月13日,PNAS杂志在线发表了一篇前列腺癌中筛选RNA拼接因子的文章,介绍基于CRISPR基因打靶文库筛选体系,鉴定到与前列腺癌有关的RNA拼接因子HNRNPL,该因子也参与调控了circRNA的形成过程[9]。文章的通讯作者为东北大学生命科学与健康学院“青年千人计划”费腾教授,哈佛大学公共健康学院/Dana-Farber癌症研究所X. Shirley Liu教授和Dana-Farber癌症研究所/哈佛大学医学院Myles Brown教授。

本文作者利用CRISPR的全基因组打靶文库筛选与前列腺癌有关的基因,聚类分析后找出了其中与RNA编辑有关的基因,其中HNRNPL是影响最为显著的。接下来作者分析了HNRNPL结合RNA的序列特异性,并基于RIP-Seq分析了该基因在前列腺癌细胞中调控RNA可变剪切和circRNA形成的作用[9]。
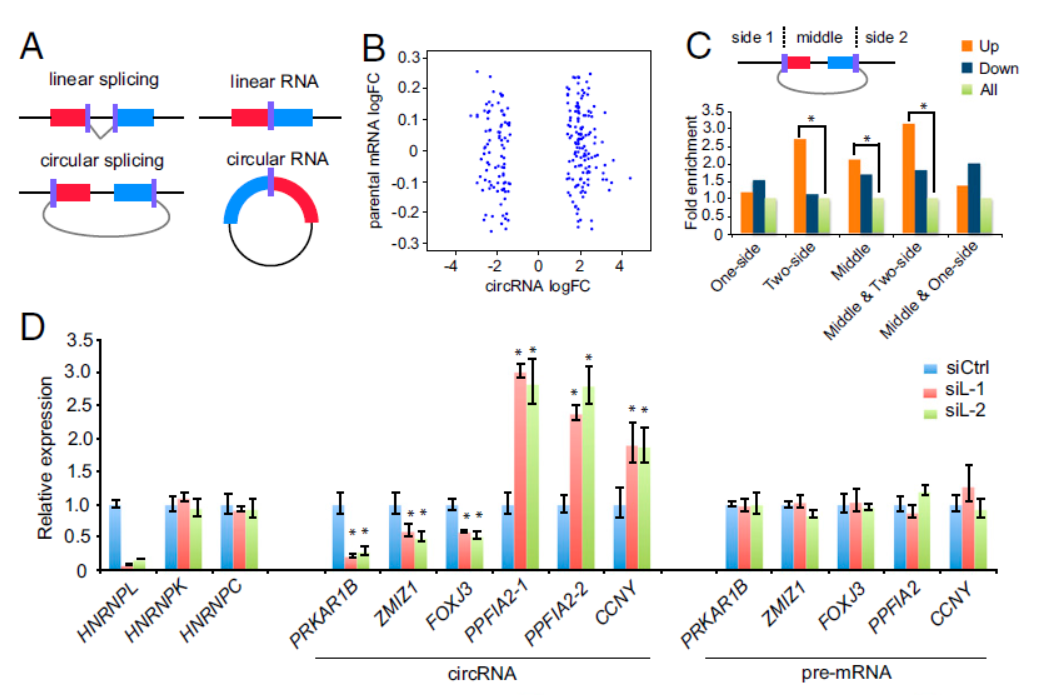
图9 HNRNPL调控RNA可变剪切和circRNA的生成(来自[9])
人干细胞多能性相关circRNA形成机理研究
10月27日,Nature Communications杂志在线发表了台湾中央研究院Kuo Hung-Chih为通讯作者的文章,报道发现circBIRC6参与干细胞多能性调控[10]。

文章报道发现干细胞中特异的RNA剪切因子ESRP1调控了circBIRC6的形成过程,circBIRC6通过竞争性结合miR-34a和miR-145参与调控干细胞多能性。ESRP1受到Oct4,Nanog等转录因子的调控。本文首次报道干细胞多能性相关的circRNA分子,是circRNA功能研究的重要扩展[10]。
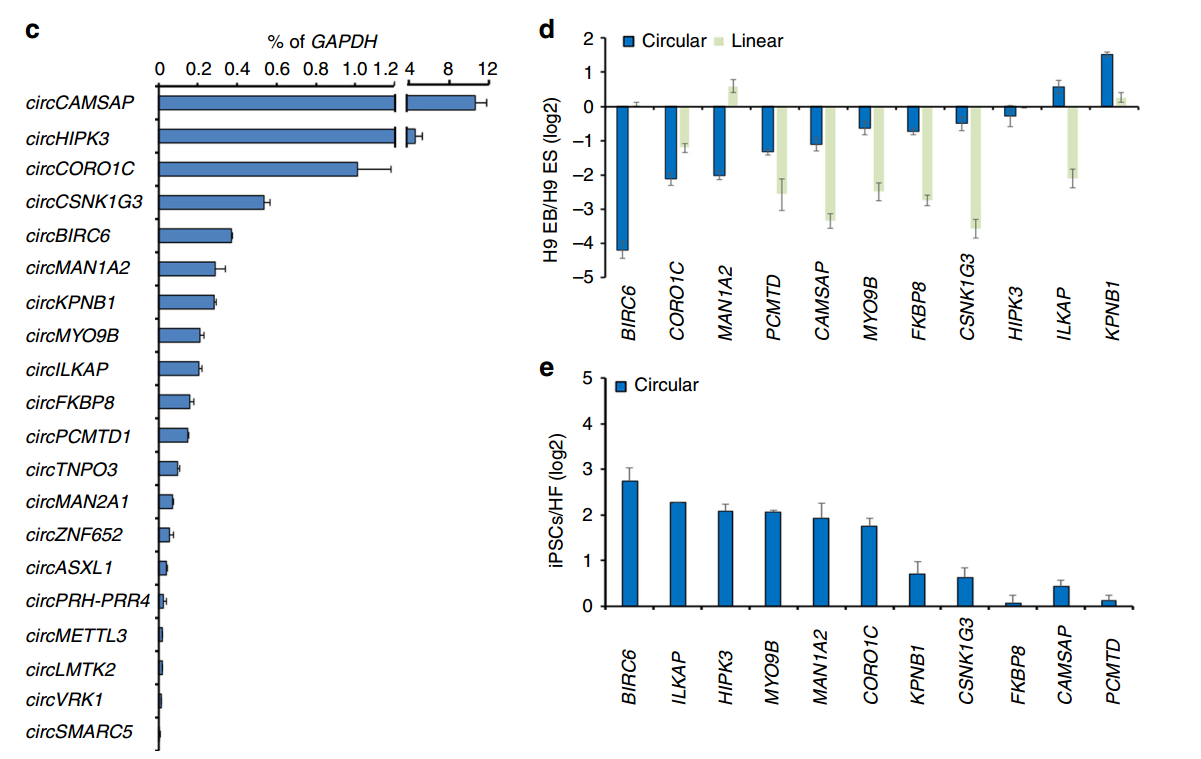
图10 体外分化实验分析多能性相关circRNA分子(来自[10])
1.3 circRNA参与生理活动功能机制研究
circRNA的功能一直滞后于表达谱分析的研究,这一局面在2017年有所改变,2017年出现了多篇关于circRNA功能的研究报道,越来越多的证据表明circRNA参与了诸多重要的生理或病理过程。由于疾病相关的circRNA研究体量巨大,后面会单独按照不同疾病类型进行分析汇总。
Science杂志发表重磅级circRNA研究论文
8月10日,Science杂志在线发表了著名RNA研究学者,马克斯·德尔布吕克分子医学中心Nikolaus Rajewsky教授作为通讯作者的研究论文,介绍其发现的Cdr1as基因敲除小鼠模型中的重要发现[11]。这是2000年以来circRNA研究领域首次问鼎该杂志,意义非凡。

本文首次尝试构建了circRNA基因敲除小鼠模型。通过合理设计,构建了彻底敲除全长CDR1as的小鼠模型,也因为所对应的互补链上CDR1基因恰好不在大脑中表达,这一敲除模型做到了单一因素敲除的效果,避免了其他因素带来的干扰。基于前期的研究,CDR1as可竞争性结合miR-7,并且受到miR-671的调控。作者从转录组到神经电生理检测,再到行为学研究,打通了CDR1as竞争性结合miR-7的分子模型在动物生理行为表型关系方面的通道,有效回到了该功能模型的生理意义问题[11]。
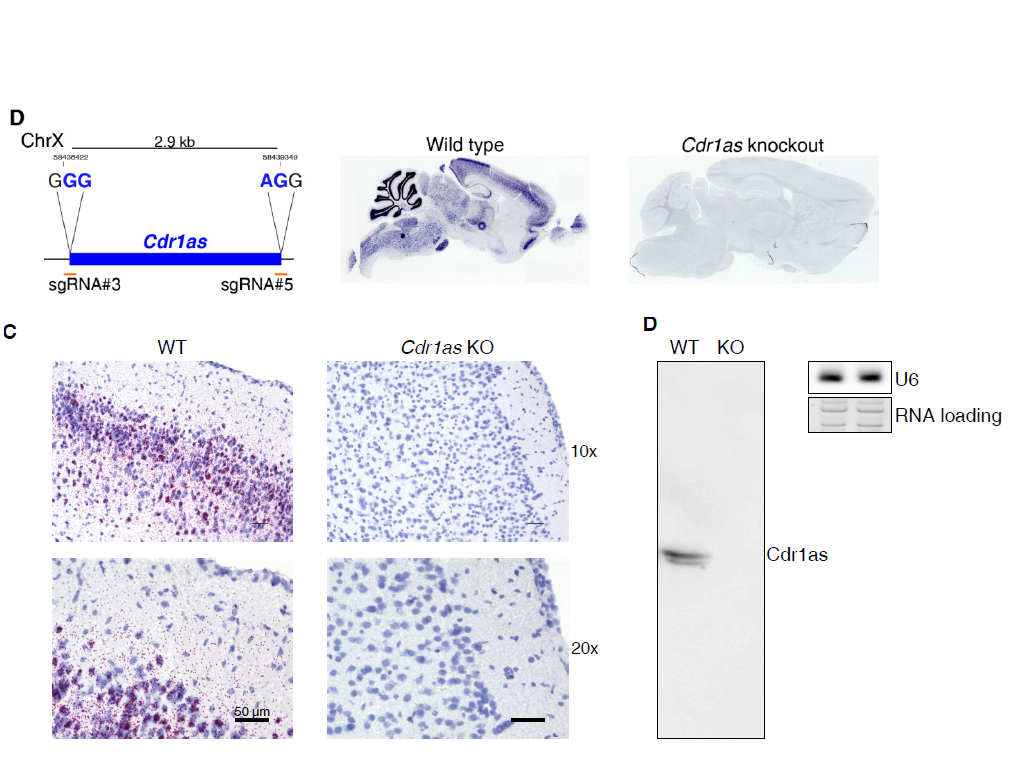
图11 CDR1as敲除小鼠鉴定(来自[11],排列稍有改动)
果蝇母系遗传内含子来源circRNA调节发育进程
3月17日,Cell子刊Current Biology在线发表了新加坡国立大学Jun Wei Pek教授为通讯作者的文章,介绍发现母系遗传的内含子来源circRNA sisR-4调控宿主基因的表达并影响发育过程[12]。

文中作者一开始希望找出果蝇发育过程中母系遗传的内含子来源的circRNA,经过RNase R处理后测序,找到了5个circRNA,再结合遗传特性,确定CG9775 和deadpan基因内含子来源的circRNA符合要求。作者在本文中重点探讨了来源于deadpan基因内含子的circRNA sisR-4在胚胎发育过程中的作用以及与宿主基因deadpan的关系。最终结果表明sisR-4可以母系遗传的方式通过提高宿主基因的表达在发育过程中发挥作用[12]。
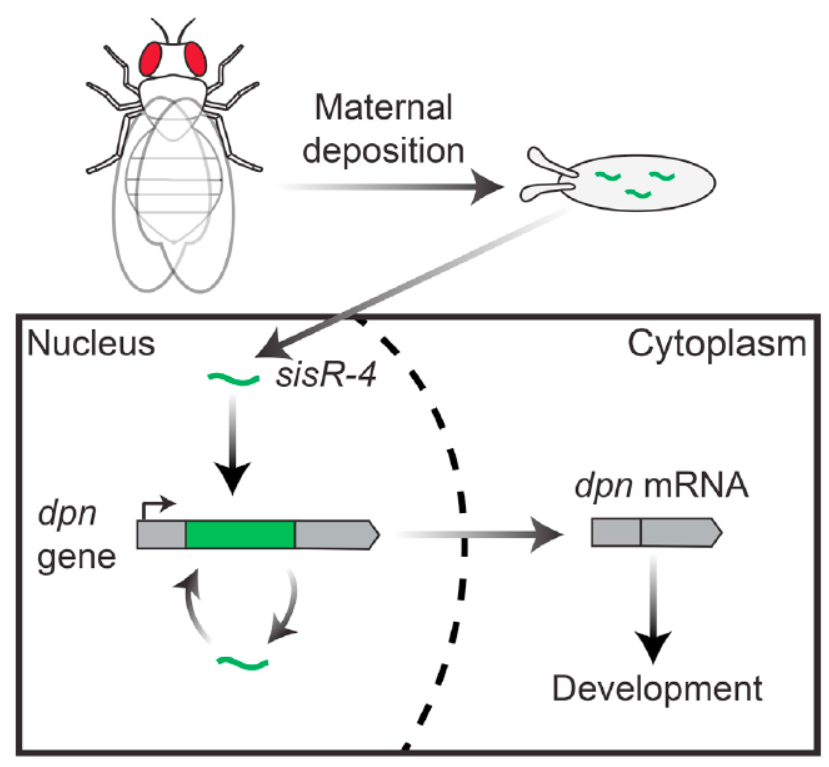
图12 内含子来源的circRNA sisR-4调控宿主基因表达和发育过程(来自[12])
细胞识别内源和外源circRNA的机制
6月15日,Molecular Cell杂志在线发表了一项重要的circRNA研究成果,介绍发现了细胞识别内外源circRNA的机制。文章的通讯作者是斯坦福大学医学院的Howard Y. Chang教授[13]。

文中作者尝试基于体外转录后自动拼接环化获得circRNA,以此转染细胞,意外的发现了体外获得的circRNA会诱导细胞自身免疫效应通路的激活,并抑制RNA病毒的感染过程,该过程由RIG-I介导,内源的circRNA由于结合一些RNA结合蛋白而不会诱导该通路[13]。
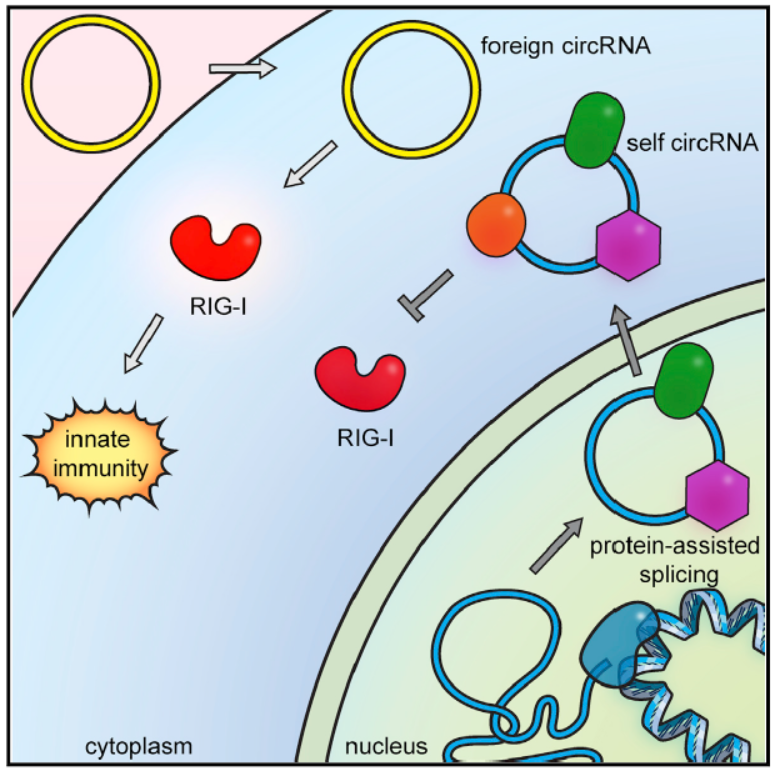
图13 外源circRNA结合RIG-I诱导免疫通路激活(来自[13])
circRNA参与调控自噬相关通路
2017年共有2篇高水平的文章报道了circRNA与细胞自噬通路的关系,东南大学姚红红教授分别在8月8日和12月20日在Autophagy杂志在线发表了相关的研究工作。下面一起回顾一下这些研究报道:
8月8日,Autophagy杂志在线发表了东南大学姚红红教授为通讯作者的文章,介绍发现circHIPK2通过靶向miR-124-2HG联合自噬及内质网应激调控星形胶质细胞活化作用[14]。

本文作者在前期研究中层发现SIGMAR1在甲基苯丙胺诱导的星形胶质细胞活化过程中的作用,本文在此基础上进一步发现circHIPK2作为miR124-2HG的内源竞争性RNA,负调控该miRNA的活性,增加SIGMAR1的表达。体内和体外敲低circHIPK2后可促进miR124-2HG的功能,进而抑制SIGMAR1的功能,进而影响自噬和内质网压力通路,最终影响星形胶质细胞活化过程[14]。
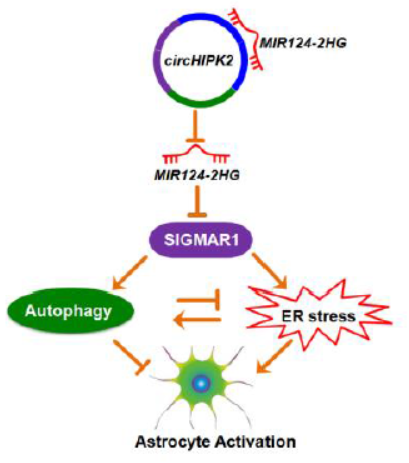
图14 circHIPK2通过miR124-2HG调控SIGMAR1影响星形胶质细胞活化(来自[14])
12月20日,Autophagy杂志在线发表了东南大学姚红红教授为通讯作者的文章,介绍发现circRNA HECW2参与ATG5的非自噬作用,涉及EMT过程[15]。

本文主要介绍发现circHECW2通过竞争性抑制miR-30D,释放ATG5,并进而促进Notch1信号通路,在上皮-间充质转变(EMT)通路中起作用[15]。
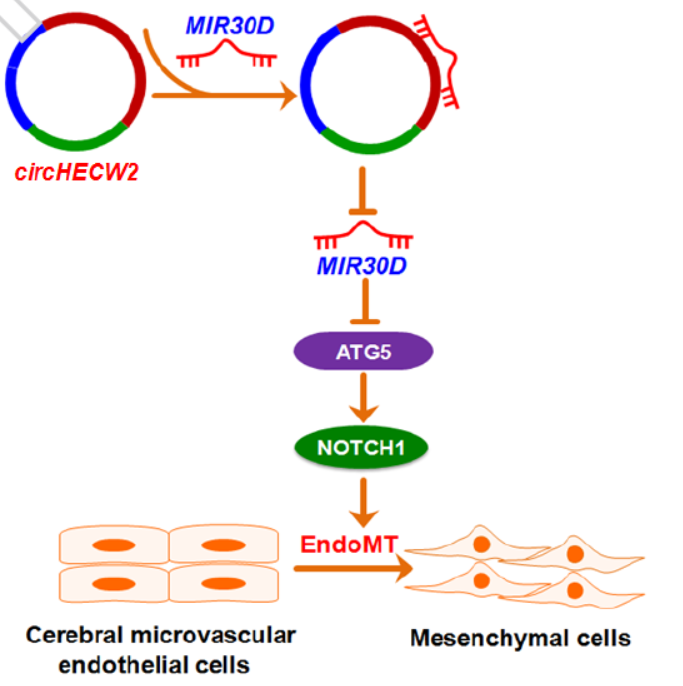
图15 circHECW2参与调控EMT通路 (来自[15])
circRNA参与二氧化硅诱导巨噬细胞活化作用
2018年1月1日,Theranostics杂志在线发表了东南大学医学院生理学系巢杰教授为通讯作者的文章,介绍发现circRNA通过HECTD1 / ZC3H12A依赖的泛素化通路介导二氧化硅诱导的巨噬细胞激活,姚红红教授为共同作者[16]。

该项研究揭示了二氧化硅诱导的巨噬细胞激活与circHECTD1 / HECTD1途径之间的联系,从而提供了新的洞察到HECTD1潜在用途在治疗矽肺治疗策略的发展[16]。
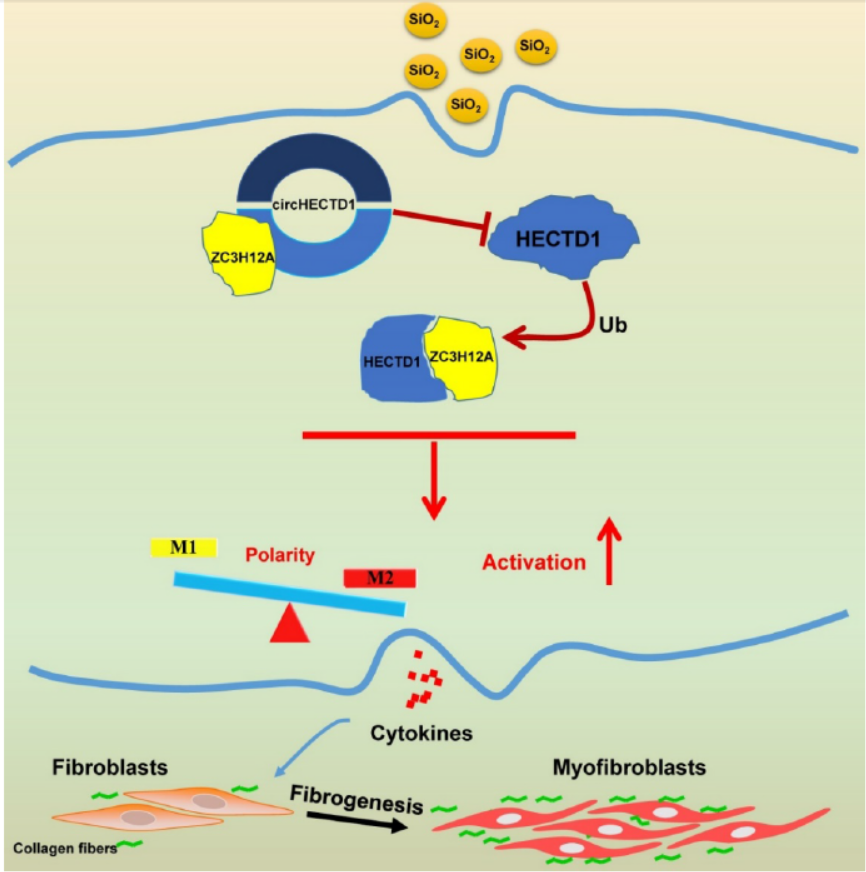
图16 circHECTD1 / HECTD1途径与二氧化硅诱导巨噬细胞活化的关系 (来自[16])
Theranostics报道circ-Amotl1参与心肌修复作用
8月29日,Theranostics杂志在线发表了加拿大多伦多大学杨柏华教授为通讯作者的文章,介绍发现circ-Amotl1通过结合PDK1和Akt促进Akt的磷酸化,并进一步转移入核,抑制细胞凋亡,促进心肌修复[17]。

作者首先发现新生儿心脏中存在一种高表达的circRNA:circ-Amolt1。进一步的研究表明circ-Amolt1可以通过与PDK1和Akt1共同相互作用,促进Akt1的磷酸化和入核。在体外的细胞以及多柔比星诱导的心肌病模型中进一步证实了该机制。已知Akt1的入核在心脏保护作用中起到信号节点的作用,本文所提出的功能机制模型是对已知模型的补充,也证明了circRNA通过与蛋白的相互作用促进蛋白功能,对于circRNA功能研究具有非常高的参考价值[17]。
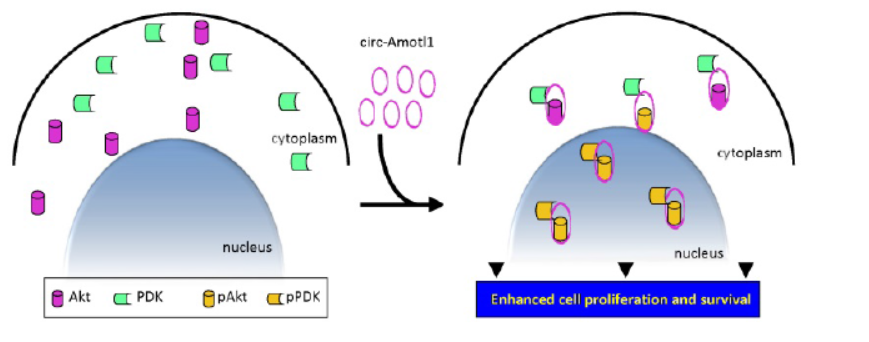
图17 circ-Amotl1结合Akt1促进其磷酸化和入核(来自[17])
ciRS-7序列隐含在一个lncRNA的序列中
12月20日,PLOS Genetics杂志在线发表了美国斯坦福大学斯坦福大学医学院生物化学系Julia Salzman教授为通讯作者的文章,介绍发现ciRS-7序列隐含在一个lncRNA的序列中[18]。该报道还曾于10月17日在预印本杂志BioRxiv上发布过。

Salzman教授通过开发新的启动子算法,证明ciRS-7与长的非编码RNA LINC00632的启动子一致。在基于多个正交实验分析验证了这个预测结果。这一研究揭示了ciRS-7的形成机制,也是经过转录后剪切形成的[18]。
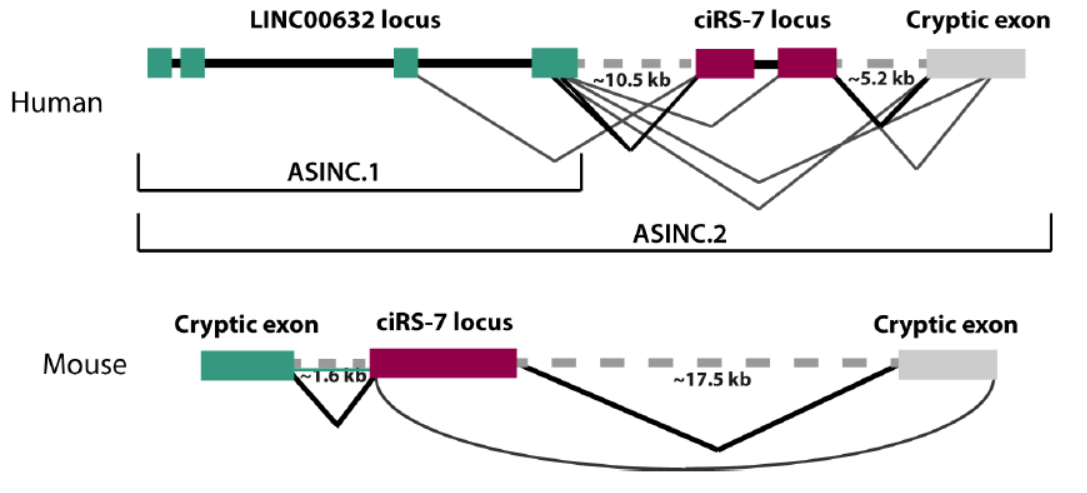
图18 ciRS-7与长的非编码RNA LINC00632的外显子结构(来自[18])
circRNA通过诱导c-Myc入核促进肿瘤生成
6月16日,Nature子刊 Cell Death & Differentiation在线发表了加拿大多伦多大学杨柏华教授为通讯作者的文章,介绍发现了circRNA circ-Amotl1通过诱导c-Myc入核而促进肿瘤发生[19]。也是在今年,杨教授也曾发表论文证明circ-Amotl1在心肌修复过程中起作用。

文中作者围绕circRNA circ-Amotl1在肿瘤中的作用机制展开了相关探索研究,发现circ-Amotl1能够通过诱导c-Myc入核促进肿瘤生成[19]。文中使用了RIP的实验技术,证明了circRNA与蛋白的相互作用。
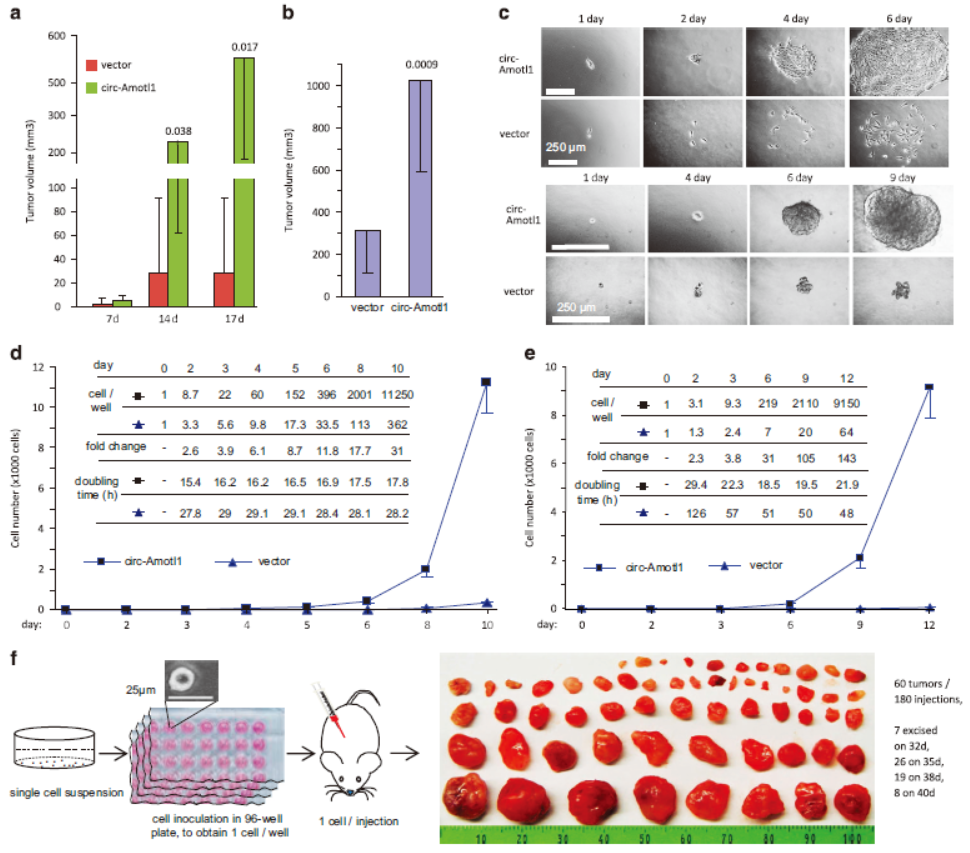
图19 过表达circ-Amotl1促进肿瘤生成(来自[19])
1.4 circRNA存在m6A修饰
核酸分子的化学共价修饰是普遍存在的生命活动过程,已有大量的文献报道发现了大量的DNA和RNA中存在的化学修饰方式。然而circRNA中的相关报道却一直是空白,这个方向也在2017年获得了突破,2017年共有两篇文章和一篇预印本文章报道发现了circRNA中存在m6A修饰。其中一篇便是上面提到的王泽峰教授发表在Cell Research杂志的研究论文。此外还有一篇Cell Reports文章和BioXrive预印本的文章报道证明circRNA存在m6A修饰:
Cell Reports报道发现circRNA存在细胞特异性m6A修饰
8月29日,Cell子刊Cell Reports在线发表了哈佛大学医学院Cosmas C. Giallourakis和Alan C. Mullen为共同通讯作者的文章,介绍发现circRNA广泛存在m6A修饰,且呈现细胞特异性的特征[20]。该研究结果曾在3月10日发表于国际著名预印本杂志BioRxiv。

本文进一步证实了circRNA中存在m6A修饰,还发现了一些m6A修饰的circRNA 的特征,包括:(1) m6A修饰的circRNA所对应的线性RNA中同一位置很少被m6A修饰,mRNA更倾向于在其3’UTR区携带m6A修饰。(2) m6A修饰的circRNA呈现高度的细胞特异性分布,相同的circRNA分子在不同的细胞中m6A修饰的状态也不尽相同。(3) m6A修饰的circRNA往往对应于较大的外显子区域,且两侧倾向于存在转座元件。(4)circRNA与线性RNA有共同的修饰酶和识别酶。METTL3参与circRNA的m6A修饰, YTHDF1/YTHDF2参与识别。(5) m6A修饰的circRNA所对应的mRNA相对更不稳定[20]。
图20 细胞特异性m6A修饰circRNA表达特征(来自[20])
| 通讯作者 | 文章题目 | 杂志 | 概要 |
| 巴黎-萨克雷大学
Hannu Myllykallio |
High-Throughput Sequencing Reveals Circular Substrates for an Archaeal RNA ligase | RNA Biology | 古细菌中circRNA相关的RNA连接酶 |
| 天津医科大学
洪伟 |
The circular RNA ciRS-7 promotes APP and BACE1 degradation in an NF-κB-dependent manner | The FEBS Journal | ciRS-7通过NF-κB通路促进APP 和 BACE1降解 |
| 广州军区总医院
Zhang Ying |
CircRNA hsa_circ_0005105 up regulates NAMPT expression and promotes chondrocyte extracellular matrix degradation by sponging miR-26a | Cell Biology International | hsa_circ_0005105上调NAMPT |
| 皖南医学院
Lv Kun |
Microarray analysis of circular RNA expression patterns in polarized macrophages | International Journal of Molecular Medicine | 利用芯片法分析了不同极化状态的巨噬细胞中circRNA的表达情况 |
| 南方医科大学
Xia Hong |
Differential circRNA expression profiles during the BMP2-induced osteogenic differentiation of MC3T3-E1 cells | Biomedicine & Pharmacotherapy | BMP2诱导MC3T3-E1细胞成骨分化过程中circRNA变化情况 |
| 俄罗斯科学院化学生物学与基础医学研究所 A. V. Savelyeva | Circular RNAs of Human Blood Cells, Plasma, and Plasma Subfractions | Russian Journal of Bioorganic Chemistry | 分析人类血细胞,血浆和血浆亚组份中circRNA的研究 |
| 四川大学华西医院
刘伦旭主任和彭勇医生 |
Profiling and bioinformatic analysis of circular RNA expression regulated by c-Myc | Oncotarget | 分析鉴定受c-Myc调控的环形RNA |
| 北京大学口腔医学院
李巍然教授 |
The Circular RNA Landscape of Periodontal Ligament Stem Cells During Osteogenesis | Journal of Periodontology | 牙周膜干细胞在造骨期间的circRNA变化情况的研究 |
| 山东大学口腔医院
魏福兰 |
Identification and integrated analysis of differentially expressed lncRNAs and circRNAs reveal the potential ceRNA networks during PDLSC osteogenic differentiation | BMC Genet | 牙周膜干细胞分化过程中circRNA和lncRNA表达变化研究 |
| 河北工程大学
Li Yan和Liu Feng-Li |
Circular RNA hsa_circ_0010729 regulates vascular endothelial cell proliferation and apoptosis by targeting the miR-186/HIF-1α axis | BBRC | circRNA hsa_circ_0010729血管内皮细胞增殖与凋亡的关系 |
| 亥姆霍兹中兴慕尼黑-德国环境卫生研究中心 Valerie Bríd O’Leary | The circRNA interactome-innovative hallmarks of the intra- and extracellular radiation response | Oncotarget | 细胞内外辐射条件下细胞中circRNA表达变化情况 |
| 上海交通大学医学院附属上海儿童医学中心 Zheng Jijian | The expression profile of developmental stage-dependent circular RNA in the immature rat retina | Molecular Vision | 未成熟大鼠视网膜中circRNA表达谱分析 |
| 苏州大学医学院
童建和聂继华 |
Circular RNA profiles in mouse lung tissue induced by radon | Environmental Health and Preventive Medicine | 氡气辐射对小鼠肺脏的circRNA表达谱影响 |
| 马克斯·德尔布吕克分子医学中心
Nikolaus Rajewsky教授和Philipp G. Maass |
Identification and Functional Characterization of Tomato CircRNAs Derived from Genes Involved in Fruit Pigment Accumulation | Journal of Molecular Medicine | 临床相关组织circRNA表达特征研究 |
| 马来西亚马来亚大学
Yat-Yuen Lim和Chee-Kwee Ea |
Transcriptomic analysis of the role of RasGEF1B circular RNA in the TLR4/LPS pathway | Scientific Reports | mcircRasGEF1B在LPS诱导的免疫信号通路中的作用 |
| 暨南大学药学院
张荣华教授和杨丽副教授 |
Changes in related circular RNAs following ERbeta knockdown and the relationship to rBMSC osteogenesis | BBRC | ERβ敲降影响rBMSC成骨作用过程中circRNA变化情况的分析 |
| 南京中医药大学
Tian Fang和Wang Qian |
Cinnamaldehyde induces cell apoptosis mediated by a novel circular RNA hsa_circ_0043256 in non-small cell lung cancer | BBRC | 肉桂醛诱导肿瘤细胞凋亡中circRNA作用 |
| 哈尔滨医科大学
张云鹏和徐娟 |
Dynamic Organization of lncRNA and Circular RNA Regulators Collectively Controlled Cardiac Differentiation in Humans | EBioMedicine | 人类心脏分化过程中lncRNA和circRNA动态变化规律 |
| 美国德州大学休斯敦健康科学中心赵中明教授与南京航空航天大学宋晓峰教授 | Circular RNA expression profiles and features in human tissues: a study using RNA-seq data | BMC Genomics | 组织特异性circRNA表达特征分析 |
| 山东大学附属省立医院
崔连群 |
Circular RNA WDR77 target FGF-2 to regulate vascular smooth muscle cells proliferation and migration by sponging miR-124 | BBRC | circWDR77通过竞争性结合miR-124影响FGF-2的功能,调控血管平滑肌细胞增殖和迁移 |
| 广州医科大学附属口腔医院
郭吕华和杨岚 |
Calcitonin generelated peptide induces IL6 expression in RAW264.7 macrophages mediated by mmu_circRNA_007893 | Molecular Medicine Reports | 小鼠巨噬细胞RAW264.7中发现Calcitonin相关多肽(CGRP)通过circRNA mmu_circRNA_007893影响IL-6通路 |
| 东南大学医学院
姚红红教授 |
Circular RNA DLGAP4 ameliorates ischemic stroke outcomes by targeting miR-143 to regulate endothelial-mesenchymal transition associated with blood-brain barrier integrity | The Journal of Neuroscience | circDLGAP4通过竞争性结合miR-143,抑制HECT结构域相关的E3泛素连接酶(HECTD1)的功能,调控血脑屏障 |
| NIH
Kotb Abdelmohsen教授 |
Identification of HuR target circular RNAs uncovers suppression of PABPN1 translation by CircPABPN1 | RNA Biology | CircPABPN1竞争性结合HuR抑制 PABPN1的翻译 |
| 瑞典乌普萨拉乌普萨拉大学
Lars Feuk |
High throughput expression profiling and in situ screening of circular RNAs in tissues | BioRxiv | 原味筛选组织中circRNA表达 |
.png)