本期特邀重庆医科大学药学院肖斌教授团队分享解读,感谢对circRNA平台的关注!
肾透明细胞癌(clear cell renal carcinoma, ccRCC)是泌尿系统常见的恶性肿瘤之一,术后复发率高,晚期患者对靶向药物不敏感,整体预后较差。环状RNA(circular RNA, circRNA)是一类在真核生物中广泛存在的非编码RNA。大量研究提示,不同于传统“非编码”RNA的定义,circRNA可作为模板翻译蛋白或多肽,成为研究circRNA功能的新思路和热点。
2024年2月15日,重庆医科大学药学院肖斌教授团队与陆军军医大学西南医院泌尿外科王永权教授、重庆大学附属肿瘤医院药剂科等合作在国际知名期刊《Molecular Cancer》(IF=37.3)上发表了题为“A novel peptide PDHK1-241aa encoded by circPDHK1 promotes ccRCC progression via interacting with PPP1CA to inhibit AKT dephosphorylation and activate the AKT-mTOR signaling pathway”的研究论文。重庆医科大学药学院博士研究生黄波、任俊伍为共同第一作者。

CircPDHK1在ccRCC中表达显著上调,并与ccRCC患者分期、分级和转移等密切相关
在本研究中,作者利用circRNA芯片分析了4对匹配的ccRCC患者肿瘤组织及其癌旁组织,共鉴定出3749个差异表达的circRNA,接下来对这3749个circRNA及其宿主编码基因线性产物进行了WGCNA检测。与癌旁组织相比较,ME blue模块中的233个circRNA在ccRCC中显著高表达。为了进一步筛选候选circRNA,作者将这233个circRNA与GEO数据库中的另一个ccRCC组织样本circRNA微阵列数据库(GSE100186)取交集,共发现了9个有显著统计学意义的circRNA作为候选,其中circPDHK1 (hsa_circ_0057090)的上调水平最高(图1 A-C)。作者发现circPDHK1在癌组织中的表达显著增加(图1 D),而且较高的circPDHK1水平与较高的WHO/ISUP分级(图1 E)、较晚期的肿瘤T分期(图1 F)和远处转移(图1 G)相关。
此外,对ccRCC患者基因检测报告的统计分析(106/148)也表明,大多数患者具有VHL突变,并且在VHL突变组中的circPDHK1水平显著高于VHL正常组(图1 H)。同时,Ki-67≥10%组的circPDHK1水平显著高于Ki-67 < 10%组(图1 I)。发散和收敛引物设计和测序、RNase R实验、Oligo dT实验和放线菌素D实验证实了circPDHK1的环状RNA特性(图1 J-O)。核质分离实验及免疫荧光实验证实circPDHK1主要定位在细胞质(图1 P-Q)。综上所述,circPDHK1在ccRCC中显著上调,并与ccRCC患者分期分级、转移和VHL突变等病理特征密切相关。
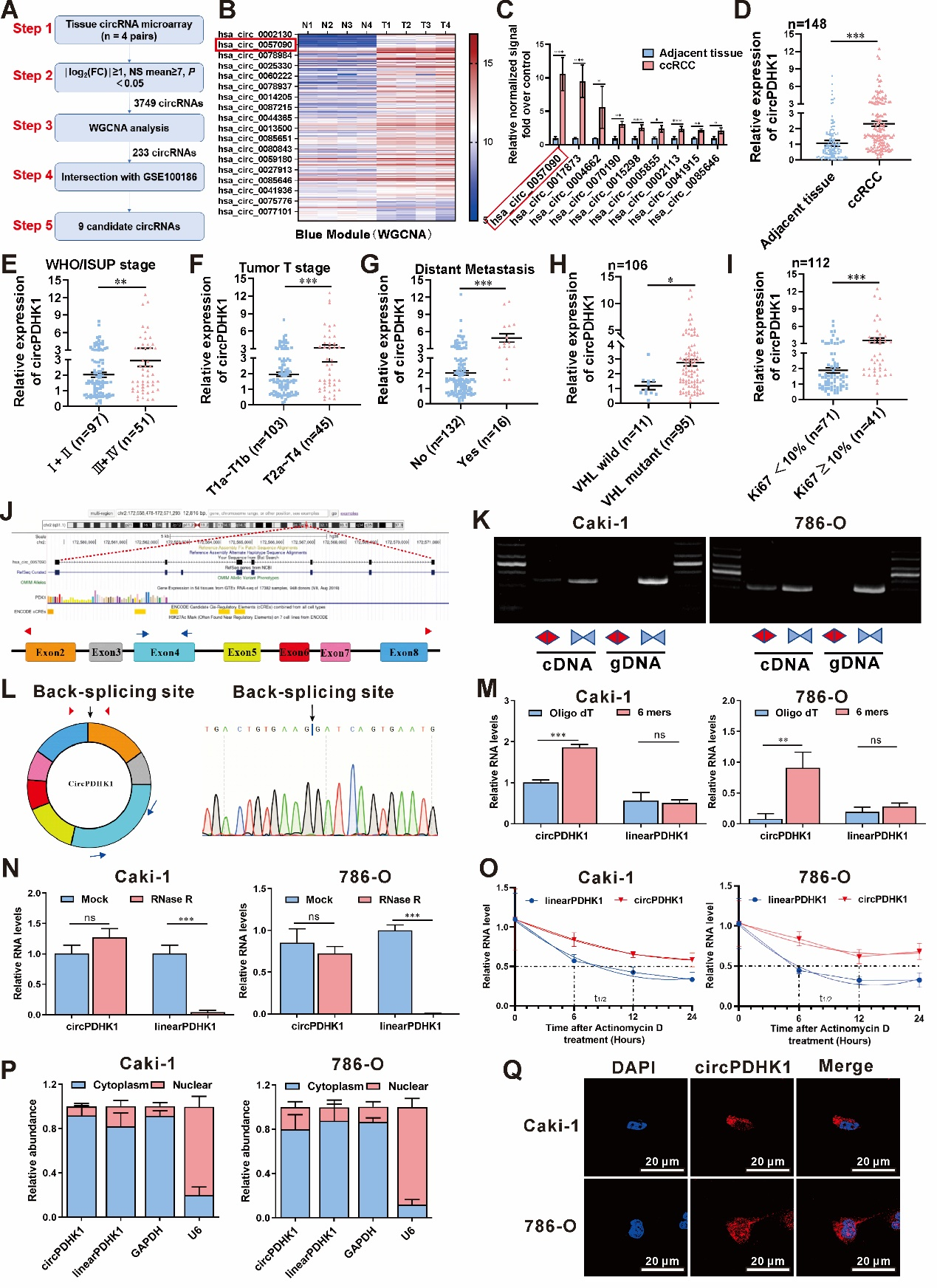 图1 鉴定circPDHK1在ccRCC中的高表达、临床相关性及环状RNA特性
图1 鉴定circPDHK1在ccRCC中的高表达、临床相关性及环状RNA特性
干扰circPDHK1可显著抑制ccRCC的增殖、转移及侵袭能力
接下来,作者研究了circPDHK1对肿瘤增殖、转移及侵袭的影响。克隆形成、CCK-8及EdU实验证实,干扰circPDHK1可抑制癌细胞增殖能力(图2 A-D);Transwell转移及侵袭实验证实,干扰circPDHK1可抑制细胞转移及侵袭能力(图2 E-I)。为了进一步评价circPDHK1对体内ccRCC发生发展的生物学作用,作者分别使用siRNA治疗皮下荷瘤NSG小鼠以及将敲低circPDHK1的稳转细胞注入(BALB/C null)裸鼠尾静脉,构建肺转移模型。与体外实验结果一致,肿瘤生长速率和肿瘤质量以及肺转移灶大小及数量明显低于对照组(图2 J-N)。综上所述,干扰circPDHK1可抑制ccRCC在体内外的增殖、转移及侵袭能力,提示circPDHK1促进ccRCC的发展。
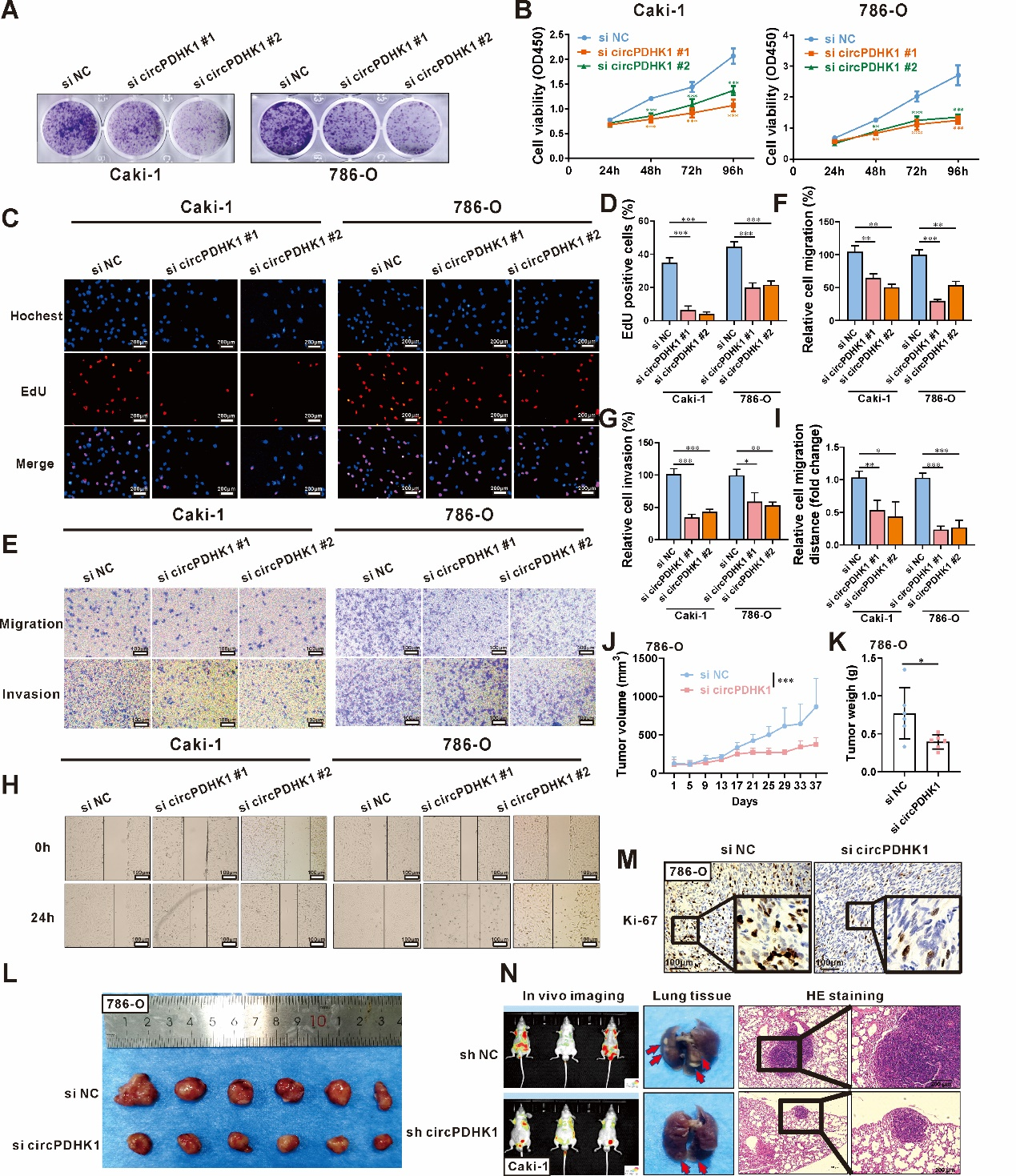 图2 干扰circPDHK1可抑制ccRCC在体内外的增殖、转移及侵袭能力
图2 干扰circPDHK1可抑制ccRCC在体内外的增殖、转移及侵袭能力
CircPDHK1 可翻译出一个新发现蛋白 PDHK1-241aa,该蛋白促进ccRCC肿瘤发展
circRNADb和Transcirc数据库预测提示,circPDHK1序列中包含一个ATG起始密码子、一个位于112-261nt的IRES和几个m6A修饰的开放阅读框(ORF),这表明circPDHK1具有编码蛋白的潜力,命名为PDHK1-241aa (图3 A)。作者进一步构建circPDHK1双荧光素酶载体,通过报告基因实验显示:与截短或突变的IRES报告基因相比,全长IRES报告基因的荧光素酶活性显著增加(图3 B-C)。为了进一步证实circPDHK1编码功能,作者构建了过表达载体(circPDHK1 3×flag)和ATG突变载体(circPDHK1 3×flag ATG mutant)(图3 D-E),转染ccRCC细胞后,RT-qPCR结果显示,两者均成功过表达circPDHK1(图3 F);但是,Western blot结果显示,过表达circPDHK1 3×flag可检测到flag标记蛋白,而circPDHK1 3×flag ATG mut未有蛋白过表达(图3 G),提示突变的ATG为IRES激活的编码蛋白预测的起始密码子,即PDHK1-241aa为circPDHK1预测的编码蛋白。免疫荧光实验发现,PDHK1-241aa 3×flag主要定位于细胞质中(图3 H)。最后通过IP实验,将flag-IP蛋白进行LC-MS质谱鉴定,并与预测的蛋白序列比对,进一步证实了circPDHK1可编码蛋白PDHK1-241aa,PDHK1-241aa-3×flag蛋白分子量为31 kDa(图3 I-J)。作者利用Novus PDHK1商业化抗体(NBP1-85955)检测ccRCC临床组织样本中PDHK1-241aa蛋白水平。结果发现,在ccRCC肿瘤组织中PDHK1-241aa水平显著上调(图3 K)。
为了研究PDHK1-241aa的生物学功能,作者构建了不含标签的过表达载体,包括pLC5-circPDHK1、pLC5-circPDHK1 ATG mut。通过体外实验(克隆形成、CCK-8、EdU 实验、Transwell转移及侵袭实验)以及体内动物实验证实,PDHK1-241aa具有促进细胞增殖、转移以及侵袭的功能(图4)。综上所述,circPDHK1能够翻译新蛋白PDHK-241aa,该蛋白促进ccRCC的肿瘤进展。
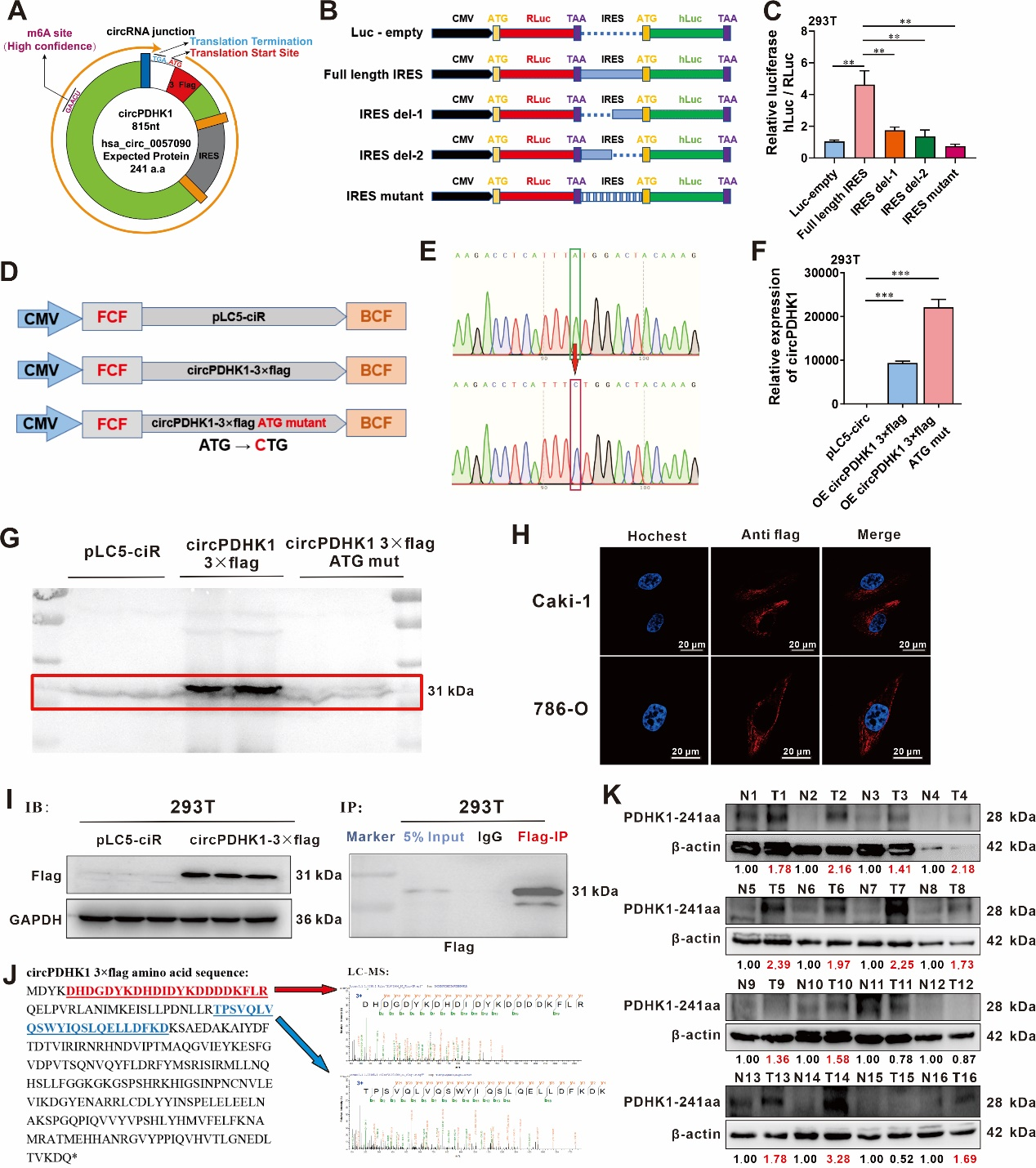 图3 circPDHK1可翻译蛋白PDHK-241aa
图3 circPDHK1可翻译蛋白PDHK-241aa
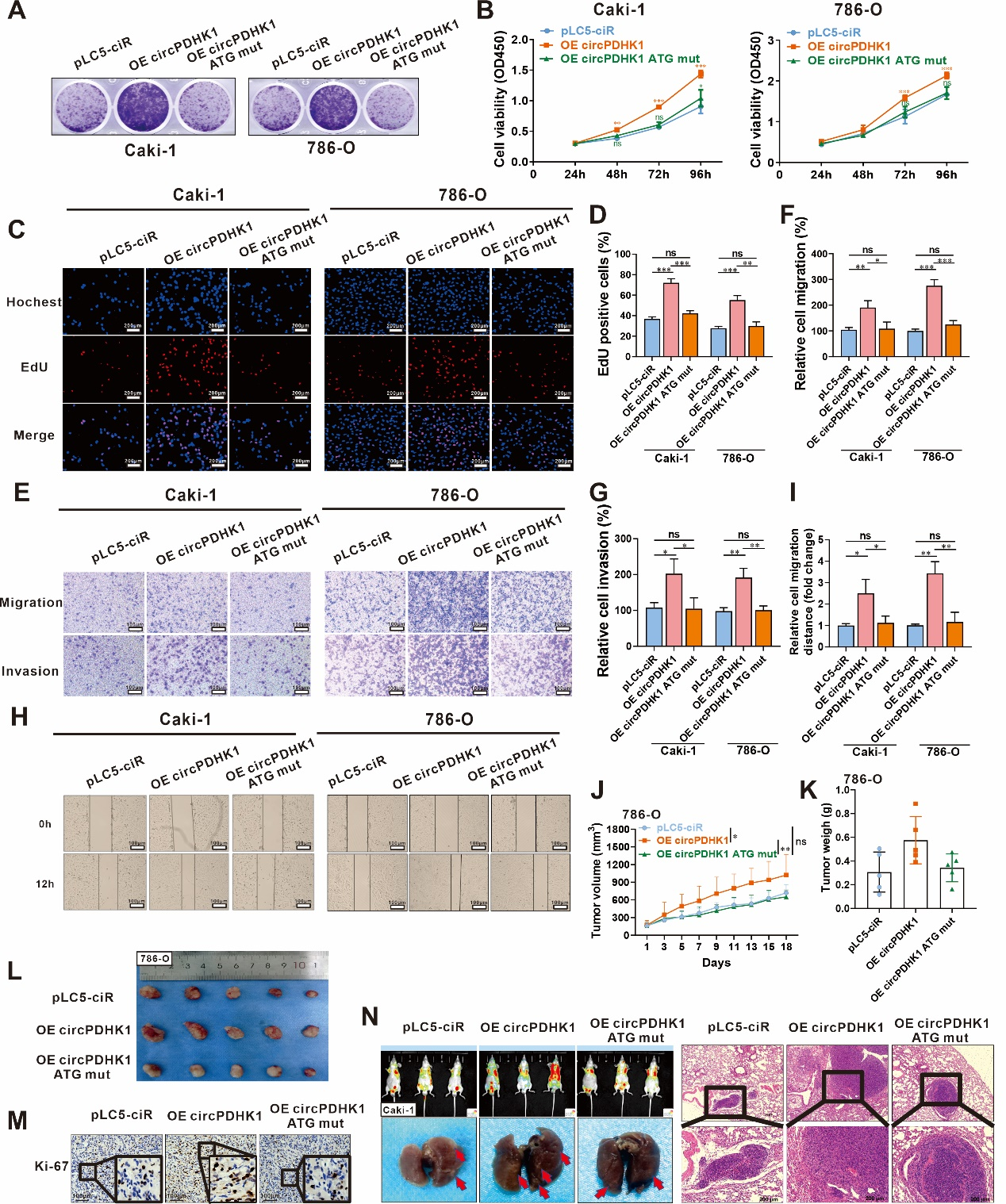 图4 PDHK1-241aa促进ccRCC增殖、迁移和侵袭能力
图4 PDHK1-241aa促进ccRCC增殖、迁移和侵袭能力
PDHK1-241aa与PPP1CA相互作用抑制AKT去磷酸化,激活AKT-mTOR信号通路,进而促进ccRCC增殖、转移和侵袭能力
作者通过RNA-seq和KEGG基因富集分析发现,在过表达或干扰circPDHK1后,PI3K-AKT信号通路基因被显著调控(图5 A-B)。基因集富集分析(GSEA)发现,AKT-mTOR信号通路与circPDHK1表达水平密切相关(图5 C)。接着,作者检测了肿瘤组织与癌旁组织中AKT-mTOR的表达,发现在肿瘤组织中, pan-AKT和mTOR总蛋白水平无明显变化,而p-AKT (Thr308)和p-mTOR (Ser2448)磷酸化水平显著升高(图5 D)。同时,circPDHK1过表达增加了p-AKT (Thr308)和p-mTOR (Ser2448)的磷酸化水平,而过表达circPDHK1 ATG mut不能调控AKT-mTOR的磷酸化水平。此外,干扰circPDHK1导致PDHK1-241aa水平下调,同时p-AKT (Thr308)和p-mTOR (Ser2448)磷酸化水平也降低(图5 E)。
有趣的是,作者通过Co-IP实验发现, PDHK1-241aa不能直接与AKT或p-AKT (Thr308)结合(图5 F)。随后,作者通过LC-MS的测序结果,筛选潜在的PDHK1-241aa结合蛋白, 结果发现PPP1CA(属于一类丝氨酸/苏氨酸蛋白磷酸酶)与PDHK1-241aa具有较高的结合系数(图5 G)。Co-IP实验证实了PDHK1-241aa可以结合PPP1CA(图5 H)。免疫荧光共定位和核质蛋白提取分离实验表明,PPP1CA定位在细胞质与细胞核,PDHK1-241aa主要定位在细胞质中,当两者共过表达结合后, PPP1CA与PDHK1-241aa发生核转位,主要位于细胞核中(图5 I-J)。随后作者构建了PDHK1-241aa截断突变体,通过Co-IP实验证实PDHK1-241aa中HATPase domain是其结合PPP1CA主要功能结构域(图5 K-N)。因此,作者推测PDHK1-241aa可能与PPP1CA结合,改变PPP1CA和PDHK1-241aa的定位,导致p-AKT去磷酸化水平减弱,继而AKT磷酸化水平升高。
后续,作者通过调控circPDHK1和PPP1CA进行回复实验,结果发现,单独干扰circPDHK1后,Caki-1和786-O细胞的增殖、转移及侵袭能力明显下降;单独干扰PPP1CA后,增殖、转移及侵袭能力上升;共干扰circPDHK1和PPP1CA,则能回复单独干扰的效应,提示两者相互作用影响ccRCC细胞体外增殖、转移及侵袭能力(图6A-G)。此外,回复实验证实,合并干扰circPDHK1和PPP1CA能回复p-AKT (Thr308)和p-mTOR (Ser2448)的磷酸化水平(图6 H)。动物实验也得到了相一致的结果,瘤内单独注射circPDHK1-siRNA显著抑制了肿瘤的生长速度、体积和重量;而当合并注射PPP1CA-siRNA后,则部分回复了circPDHK1-siRNA的抑瘤效果(图6 I-M)。综上所述,PDHK1-241aa与PPP1CA相互作用抑制AKT去磷酸化,激活AKT- mTOR信号通路,进而促进ccRCC增殖、转移和侵袭能力。
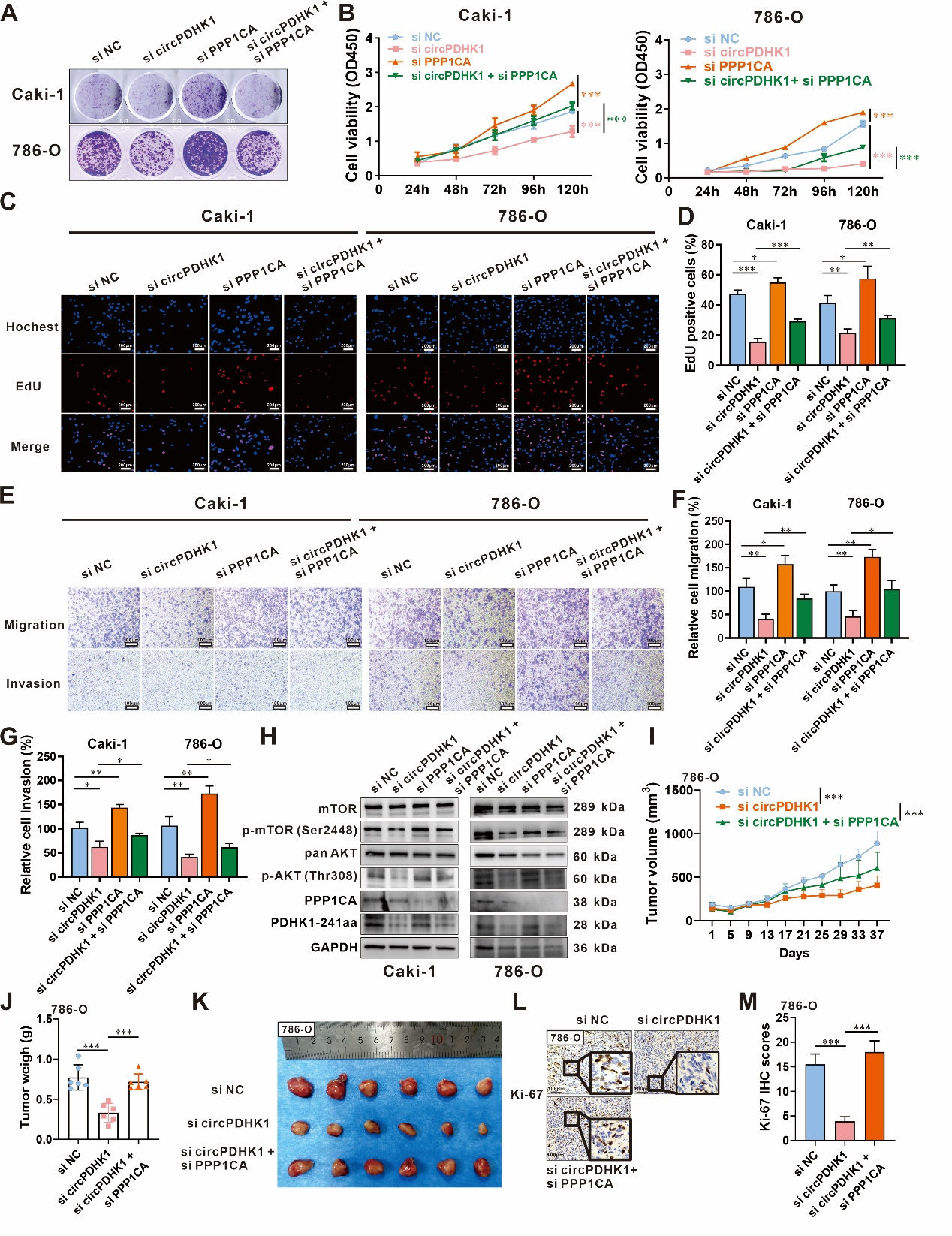 图5 PDHK1-241aa与PPP1CA相互作用抑制AKT去磷酸化,激活AKT- mTOR信号通路
图5 PDHK1-241aa与PPP1CA相互作用抑制AKT去磷酸化,激活AKT- mTOR信号通路
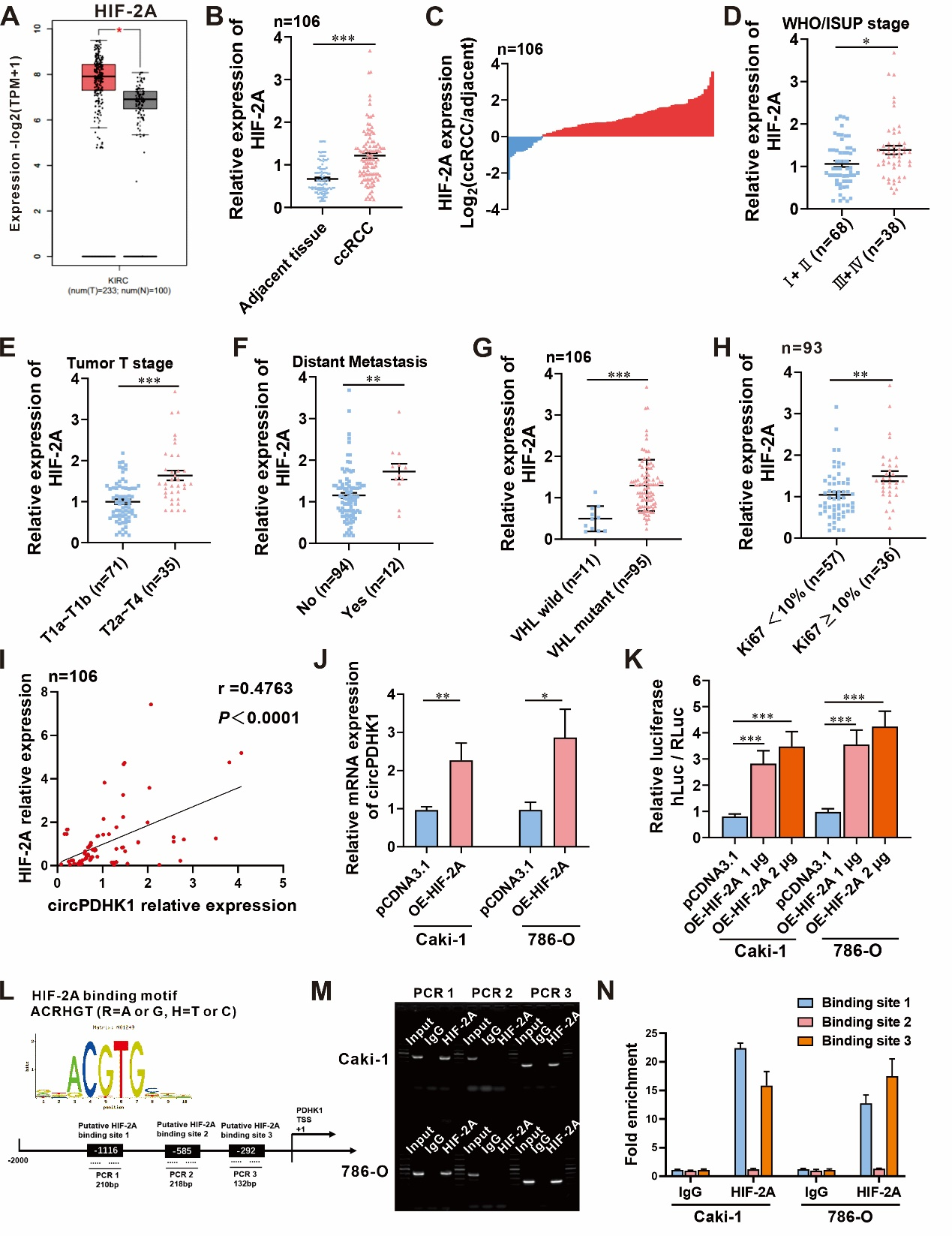 图6 circPDHK1和PPP1CA共转染siRNA表型回复实验
图6 circPDHK1和PPP1CA共转染siRNA表型回复实验
HIF-2A通过调控circPDHK1转录进而影响ccRCC增殖、转移及侵袭能力
鉴于circRNA的生成是从pre-RNA的转录开始,我们推测circPDHK1的生成可能与亲本基因PDHK1调控密切有关。已有报道,另一个来源于PDHK1的circRNA (hsa_circ_0057104)被HIF-1A转录激活。同时,HIF 家族(HIF-1A和HIF-2A)在ccRCC发生中起重要作用。因此,作者首先通过TCGA数据库发现HIF-2A在ccRCC肿瘤组织中显著高表达,而HIF-1A的表达并无显著差异;其次,作者检测了106对ccRCC肿瘤及癌旁组织HIF-2A的表达水平,证实了HIF-2A的高表达及与临床病理的相关性,且circPDHK1与HIF-2A的表达呈正相关(图7 A-I)。因此,作者假设circPDHK1的上调可能与HIF-2A表达有关。为了验证这一假说,将HIF-2A过表达质粒转染到ccRCC细胞中,观察到circPDHK1表达显著增加(图7 J)。双荧光素酶报告基因实验结果显示,当HIF-2A过表达时,含有PDHK1启动子序列的报告基因系统荧光素酶活性上升 (图7 K)。作者通过启动子序列分析工具(Contra Ver. 3),在circPDHK1的基因组启动子区域发现了三个潜在的HIF-2A HREs (ACRHGT, R=A或G, H=T或C)(图7 L)。ChIP-qPCR证实了HIF-2A可以直接结合基因组PDHK1启动子区域的1和3位点(图7 M-N)。
此外,作者通过一系列细胞功能实验和回复实验(同时过表达HIF-2A和干扰circPDHK1),证实HIF-2A-circPDHK1调控轴促进ccRCC细胞的增殖、转移及侵袭能力(图8)。综上所述,HIF-2A作为转录因子激活前体PDHK1转录,进而导致circPDHK1表达水平上升,从而发挥促进ccRCC增殖和转移的功能。
 图7 circPDHK1的生成受HIF-2A的转录调控
图7 circPDHK1的生成受HIF-2A的转录调控
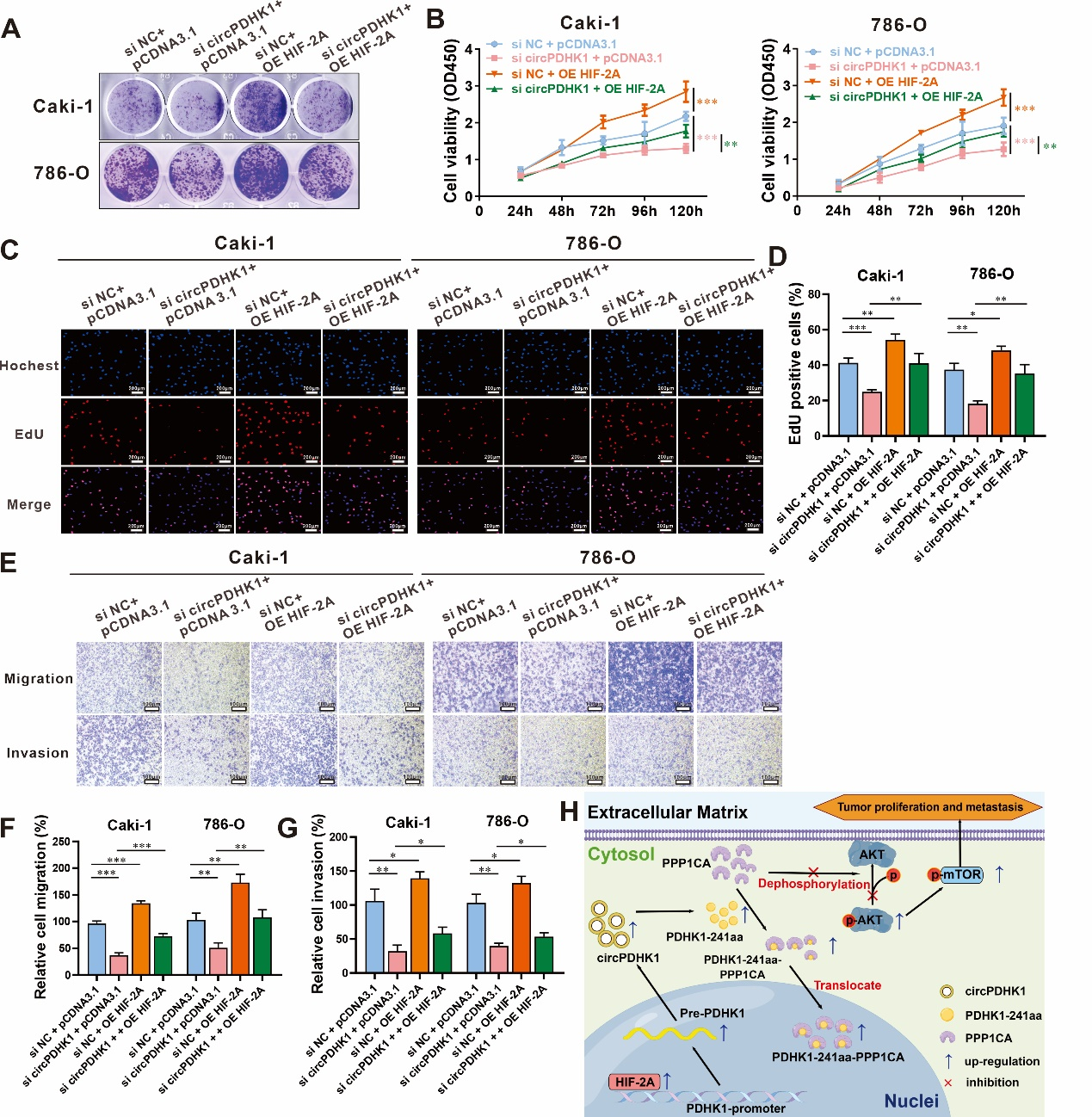 图8 circPDHK1 siRNA和HIF-2A过表达的共转染表型回复实验
图8 circPDHK1 siRNA和HIF-2A过表达的共转染表型回复实验
总结
该研究系统筛选了ccRCC中差异表达的circRNA,发现了一个新的circRNA: circPDHK1,其在ccRCC中显著高表达,且与肿瘤患者分期、分级和转移密切相关。研究证实,circPDHK1具有翻译能力,可编码一个新蛋白PDHK1-241aa。体内外功能实验表明,circPDHK1通过编码PDHK1-241aa,促进ccRCC的生长和转移。在作用机制方面,研究发现,HIF-2A可激活PDHK1前体RNA转录,上调circPDHK1的表达。PDHK1-241aa能与PPP1CA蛋白结合,促进PPP1CA核转位,抑制PPP1CA对AKT的去磷酸化功能,从而激活AKT-mTOR信号通路。此外,研究还发现, 抑制ccRCC细胞中circPDHK1的表达,可以提高细胞株对TKIs药物(例如:舒尼替尼、帕唑帕尼)的敏感性。上述研究为阐明ccRCC的发生与转移机制提供了新思路,也为研发治疗ccRCC的生物技术药物提供了新靶点(图8H)。
原文链接
https://doi.org/10.1186/s12943-024-01940-0
.png)