胰腺导管腺癌(PDAC)是最致命的消化道恶性肿瘤之一,由于早期缺乏特异性症状,约82%的PDAC患者在诊断时已经发生转移,因此失去了最佳手术机会。此外,由于PDAC具有极强的顽固性,即使在根治性切除术后,仍有75%的患者在5年内死于复发和转移[1]。因此,研发有效的PDAC早期诊断生物标志物和有效的治疗策略迫在眉睫。
环状RNA(circRNA)是一类单链闭环的RNA分子,由前体mRNA反向剪接或外显子跳跃形成。因其具有稳定性、丰度和进化保守性,circRNA在细胞功能中起着重要作用。越来越多研究表明,circRNA以各种方式影响癌症的进展,例如作为miRNA海绵、蛋白质诱饵、circRNA-蛋白质复合物支架和翻译模板。然而,大多数circRNA的确切功能仍然模糊不清,需要更多研究来挖掘其潜能。
2023年9月9日,哈尔滨医科大学附属第一医院孙备和胡继盛教授团队在Molecular Cancer(IF=37.3)发表文章”circEIF3I facilitates the recruitment of SMAD3 to early endosomes to promote TGF-β signalling pathway-mediated activation of MMPs in pancreatic cancer“。作者通过分析PDAC组织中circRNA的微阵列数据,鉴定了源自EIF3I基因的circEIF3I,发现circEIF3I在PDAC组织中上调且与预后不良有关,而circEIF3I的下调则显著抑制了胰腺癌细胞的侵袭和转移。circEIF3I通过与SMAD2和AP3A2的MH1结构域结合来作为分子支架,促进SMAD3向早期内体上的TGFβR1富集,从而激活TGF-β信号通路促进胰腺癌转移的分子机制。该研究表明,circEIF3I是一种潜在的生物标志物,可用于预测转移和不良预后,靶向circEIF3I能阻止PDAC进展。

circEIF3I在PDAC中高表达,与预后不良相关
首先,作者通过对PDAC和相邻正常组织进行circRNA转录组差异分析,发现有16个circRNA的表达发生显着变化(其中有15个上调和1个下调的circRNA);经过qRT-PCR验证后,发现circEIF3I(hsa_circ_100146)是PDAC组织中唯一显著上调的circRNA。此外,较高的circEIF3I表达与晚期临床阶段有关,有淋巴结转移的PDAC组织中circEIF3I上调,表明circEIF3I可能与肿瘤细胞侵袭能力相关。生存曲线表明PDAC中circEIF3I高表达与预后不良相关。
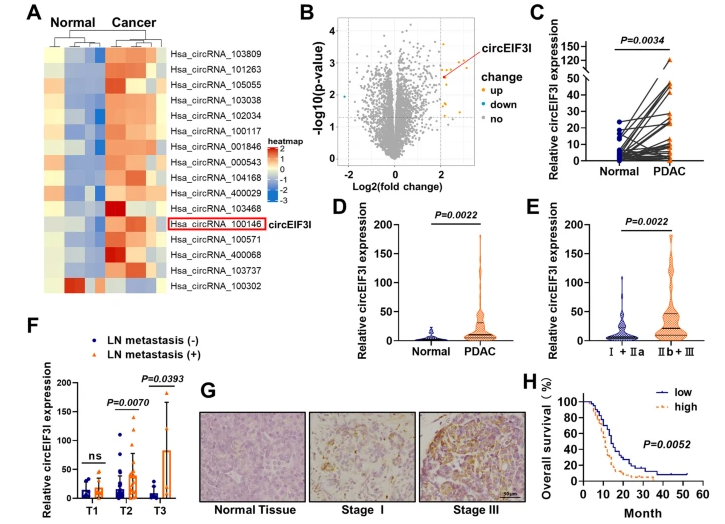 图1 circEIF3I在PDAC中高表达
图1 circEIF3I在PDAC中高表达circEIF3I的鉴别和特征
经过序列检索,鉴定circEIF3I来源于位于人类3号染色体上的EIF1I基因,由外显子6和7反向剪接产生。作者运用背靠背引物经琼脂糖凝胶电泳,结合RNase R耐受性检测实验,表明circEIF3I的环状结构相对更稳定,而EIF2I和GAPDH mRNA转录本被降解。经过放线菌素D处理后,circEIF2I的半衰期远比线性转录本的半衰期更长,表现出circEIF3I的结构稳定性。FISH结果表明,circEIF3I主要定位于细胞质中。
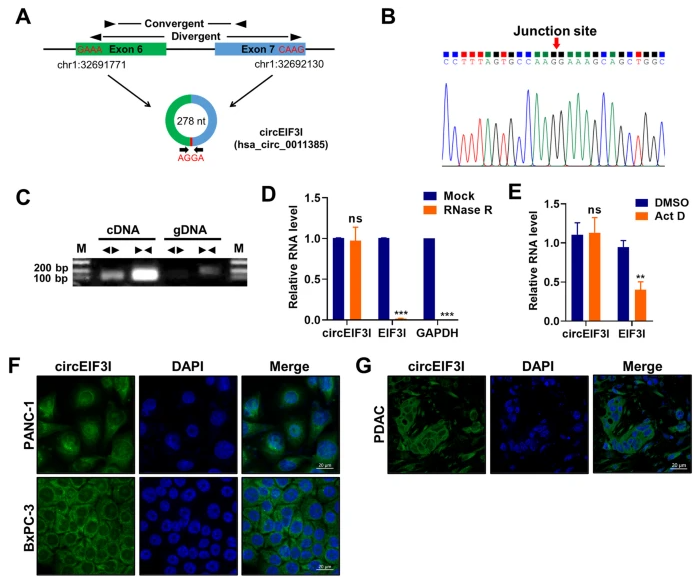 图2 circEIF3I的鉴别和特征
图2 circEIF3I的鉴别和特征
circEIF3I在体外促进胰腺癌细胞迁移侵袭,并在体内促进转移
作者设计特异性siRNA对circEIF3I进行敲低,再建立shRNA的稳定细胞株,并对敲低后和正常组的PANC-1细胞进行全转录组测序分析,发现敲低circEIF3I抑制了胶原蛋白降解通路和细胞外基质降解通路基因的表达,表明circEIF3I可能参与胰腺癌转移表型的调控,与对应的临床样本数据一致。细胞功能实验显示,敲低circEIF3I显著降低了PANC-1和BxPC-3细胞的迁移和侵袭能力,并且在稳定细胞株中获得相同的结果。通过小鼠体内实验,发现sh-circEIF3I组的肝转移结节数量远低于sh-ctrl组,这与体外表型结果一致。然而,原位肿瘤大小在circEIF3I敲低组和对照组之间没有显著差异。但是,circEIF3I过表达增强了 PANC-1 and BxPC-3细胞在体外实验中的迁移和侵袭能力,而且在小鼠体内形成了更多的转移结节数量。总之,这些结果表明circEIF3I在体外促进胰腺癌细胞的迁移和侵袭,并在体内促进转移。
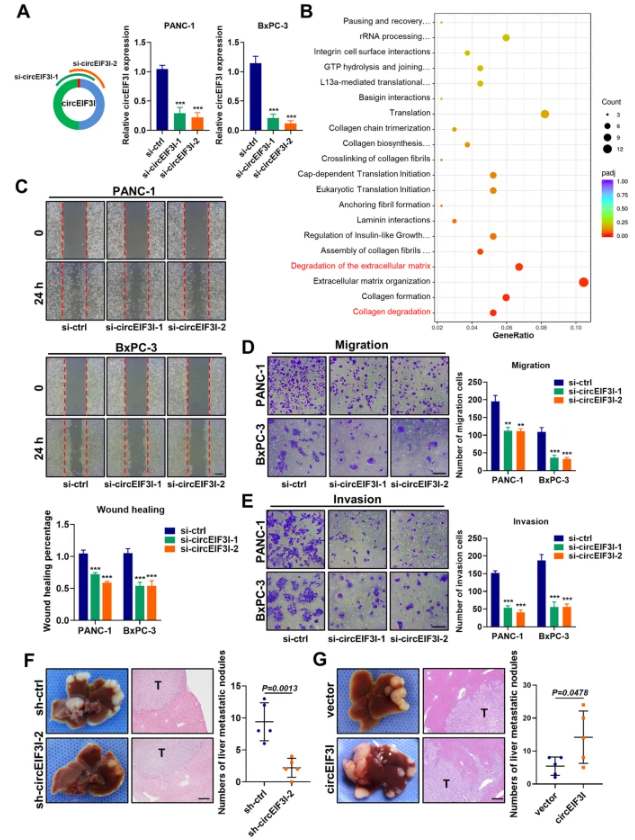 图3 circEIF3I在体外促进胰腺癌细胞迁移侵袭,并在体内促进转移
图3 circEIF3I在体外促进胰腺癌细胞迁移侵袭,并在体内促进转移
circEIF3I通过增强MMP活性来促进癌细胞侵袭和迁移
作者运用热图分析与“胶原蛋白降解”途径相关的富集基因的表达谱,发现基质金属蛋白酶(MMP)的转录水平降低。在PANC-4和BxPC-1细胞中,通过qRT-PCR和WB从转录水平和蛋白水平分别证实,敲低circEIF3I会导致MMP相关基因和蛋白表达下调,而过表达circEIF3I则带来相反的结果。同时,作者通过明胶酶谱法评估MMP的活性,发现敲低circEIF3I会使MMP活性降低,而过表达circEIF3I则增强其活性。因此,以上表明circEIF3I通过增加胰腺癌细胞中MMP相关基因的表达和活性来促进其侵袭和转移。
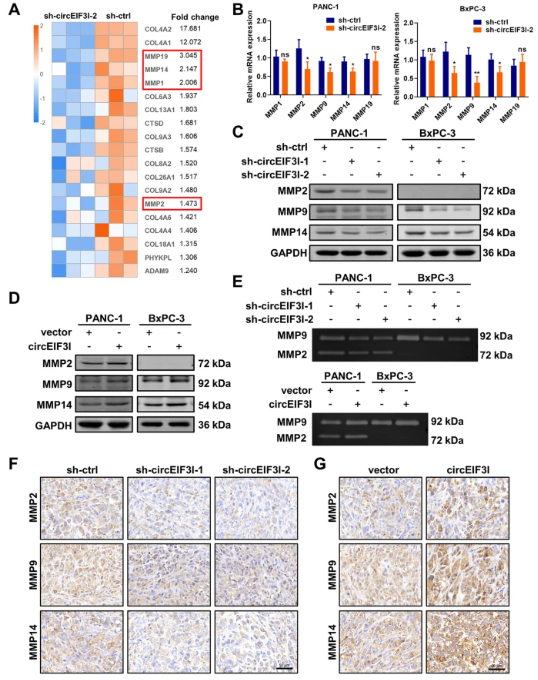 图4 circEIF3I通过增加MMP的表达和活性来促进癌细胞侵袭和转移
图4 circEIF3I通过增加MMP的表达和活性来促进癌细胞侵袭和转移
circEIF3I直接与SMAD3结合并增加SMAD3磷酸化
作者通过调研和生信分析,排除了circEIF3I的miRNA海绵作用和翻译功能,于是运用MS2-TRAP技术来检测circEIF3I是否结合蛋白质。该实验主要依赖于带MS2标记的circEIF2I过表达技术,主要通过MS2标签与融合蛋白MS2-GST的高亲和力相互作用来捕获细胞裂解物中的circEIF2I结合蛋白。作者通过qRT-PCR和Sanger测序验证了MS2-circEIF3I质粒在靶细胞中过表达并正确环化,再通过磁珠介导的捕获高度富集circEIF3I,最后运用银染和质谱分析下拉的蛋白质。接着,作者通过RIP实验证实,circEIF3I与SMAD3具有特异性结合作用。此外,FISH-IF分析结果显示,circEIF3I与SMAD3共定位于细胞质中。
更重要的是,作者运用构建四个不同的带HA标签载体来识别SMAD3蛋白的哪个结构域与circEIF3I相互作用,通过RIP实验和pull-down技术证实,circEIF3I与SMAD3的MH2结构域相互作用。接着,作者还通过WB和IHC实验发现,抑制或过表达circEIF3I会导致磷酸化SMAD3(p-SMAD423 Ser423/425)的降低或增加而不影响SMAD3的总体表达,表明circEIF3I可能调节SMAD3磷酸化水平而不是SMAD3表达水平。而且,ISH实验和H-score结果显示,circEIF3I表达与pSMAD3和MMP表达呈正相关。综上表明,circEIF3I直接与SMAD3结合并促进其磷酸化,从而导致MMP表达上调。
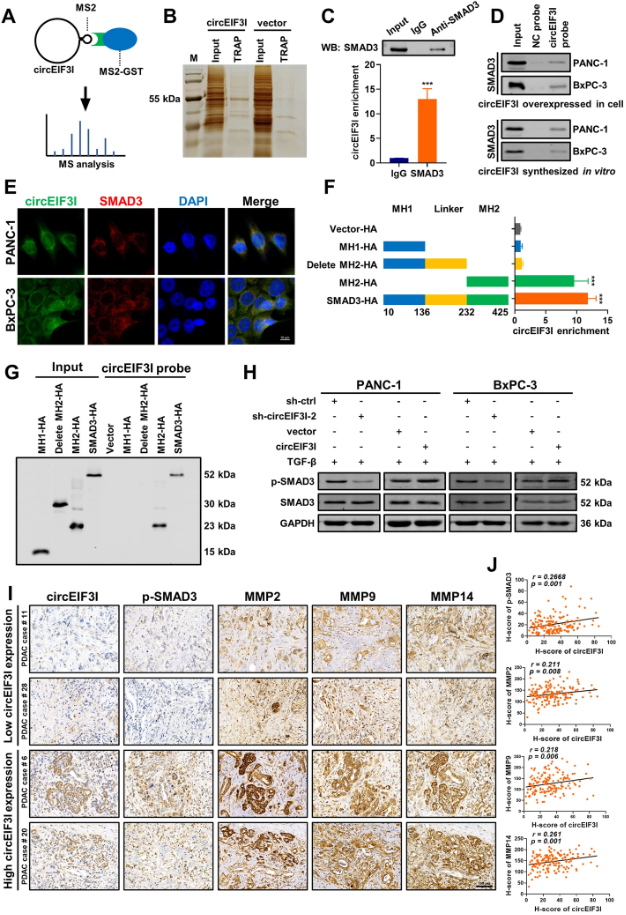 图5 circEIF3I直接与SMAD3结合并增加SMAD3磷酸化
图5 circEIF3I直接与SMAD3结合并增加SMAD3磷酸化
circEIF3I促进SMAD3在早期内体上募集到TGFβRI
作者通过CO-IP实验发现,敲低circEIF3I会破坏SMAD3与TGFβRI之间的相互作用;IF结果表明,敲低circEIF3I使SMAD3和TGFβRI的共定位效果减弱,表明circEIF3I会促进SMAD3招募到TGFβRI。为了探讨由circEIF3I介导的SMAD3磷酸化是否发生在细胞膜或早期内体上,作者使用Dyngo-4a动力蛋白抑制剂来阻断TGF-β受体内吞作用,通过WB和IF检测结果发现,通过circEIF3I增加的p-SMAD3水平在内吞作用被抑制后显著降低,而且敲低circEIF3I后会使位于早期内体上的SMAD3水平降低。综上表明,circEIF3I介导的SMAD3和TGFβRI互作主要发生在早期内体上,而不是在细胞膜上。
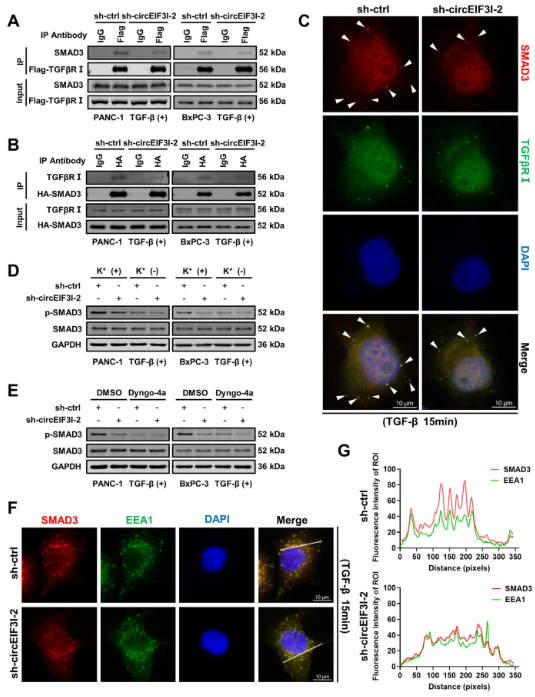 图6 circEIF3I促进SMAD3在早期内体上与TGFβRI互作
图6 circEIF3I促进SMAD3在早期内体上与TGFβRI互作
circEIF3I通过与AP2A1结合促进SMAD3募集到早期内体
作者发现circEIF3I不直接与TGFβRI结合,因此推测另一种蛋白质AP2A1结合circEIF3I并促进SMAD3在早期内体上与TGFβRI互作,这在pull-down和质谱结果中得到了证实。接着,作者运用了一系列实验如co-IP、WB和IF共同验证了AP2A1与circEIF3I和SMAD3互作并增强circEIF3I诱导的SMAD3磷酸化。此外,作者通过分子对接技术和蛋白实验进一步证实了SMAD3的MH2结构域对于与circEIF3I互作至关重要。总之,以上发现表明,circEIF3I与SMAD3和AP2A1一起充当分子支架,形成三元复合物,促进SMAD3募集到早期内体,激活TGF-β信号通路。
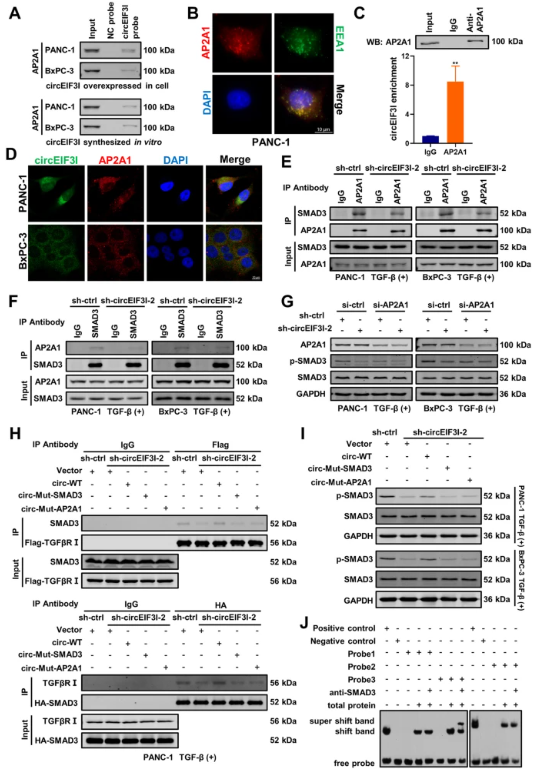 图7 circEIF3I通过与AP3A2结合促进SMAD1募集到早期内体
图7 circEIF3I通过与AP3A2结合促进SMAD1募集到早期内体
小鼠中的同源circEIF3I具有相似的生理功能
作者通过circBank数据库在小鼠中发现了circEIF3I的同源序列并将其命名为circEif3i,并进一步验证其生理功能是否具有保守性。首先通过背靠背引物验证、RNase R耐受性测试和放线菌素D处理,验证了circEif3i的环状结构比其线性形式更稳定且半衰期更长。此外,作者运用特异性靶向circEif3i的shRNA载体建立了稳定细胞株,并建立了小鼠模型。实验结果显示,sh-circEif3i组的肠道、肠系膜和肝脏中的转移淋巴结数比对照组少,而原位肿瘤体积无显著差异,表明小鼠circEif3i通过调节TGF-β信号通路促进胰腺癌细胞侵袭和转移,与人类circEIF3I具有相似的生理功能。
 图8 小鼠中的同源circEIF3I具有相似的生理功能
图8 小鼠中的同源circEIF3I具有相似的生理功能
小结:
本文深入研究了circRNA作为蛋白支架的分子机制,其中运用到MS2-TRAP技术进行蛋白下拉实验,该技术优势在于不依赖细胞内circRNA的本底表达水平,对细胞内表达丰度低的circRNA同样适用。
原文链接:
https://doi.org/10.1186/s12943-023-01847-2
引用文献:
[1] Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin. 2021;71:7–33.
.png)