肝癌是全球癌症相关死亡的第四大原因,而肝细胞癌(HCC)占原发性肝癌的大多数。尽管有一个全面的治疗方案,但晚期HCC患者的预后仍然很差。早期肝内转移,特别是微转移,是HCC治疗和预后改善的巨大难题。深入了解HCC的进展机制可能是药物开发的关键。环状RNA(circRNA)VAMP3驱动CAPRIN1的LLPS促进细胞质中应激颗粒的形成,环状RNA如何影响LLPS已引起了研究者的广泛关注,但是具体的作用机制还需要进一步研究。
2023年7月25日,浙江大学医学院附属邵逸夫医院胃肠外科蔡秀军/史亮团队在PNAS(IF=11.1)发表文章【Cytoskeleton remodeling mediated by circRNA-YBX1 phase separation suppresses the metastasis of liver cancer】。作者研究发现了一种核环状RNA-circASH2,它在HCC组织中最先丢失,并通过改变肿瘤的细胞骨架结构来抑制HCC的转移。原肌球蛋白4(TPM4)是肌动蛋白的一个关键结合蛋白,是circASH2的主要靶点,并在转录后被抑制。这种调控是基于信使RNA(mRNA)/前体mRNA的剪接和降解过程。此外,研究还发现由circASH2增强的核Y-box结合蛋白1(YBX1)的液-液相分离增强了TPM4转录本的衰减。文章揭示了肿瘤抑制的circRNA,并揭示了HCC进展的精细调节机制。
浙江大学医学院附属邵逸夫医院普外科刘柏强博士、博士研究生沈皓为论文的共同第一作者,蔡秀军教授和史亮特聘副研究员为本文的通讯作者。研究工作还得到了单革教授团队的帮助与支持。
circASH2是一种参与HCC转移的circRNA
首先,作者分别对5个高侵袭性HCC组织(HI-HCC)和5个低侵袭性HCC组织(LI-HCC)进行circRNA微阵列检测来分析其表达谱。发现一个环状RNA,circASH2(hsa_circ_0006302)可能具有肿瘤抑制作用。作者通过circBase数据库、RT-PCR和Sanger测序确定了circASH2的环化位点。接着作者发现circASH2在非转移细胞系中的表达水平显著高于转移细胞系,说明circASH2在HCC转移中发挥着重要作用,RT-PCR和RNA荧光原位杂交FISH验证其在HCC组织中低表达;另外只有沉默DHX9,而不是ADAR1或QKI,增强了circASH2的表达,从而降低了mASH2,也证实了circASH2的下调与HCC中过表达DHX9相关。综上所述,circASH2在HCC中具有转移抑制作用,并受DHX9调控。
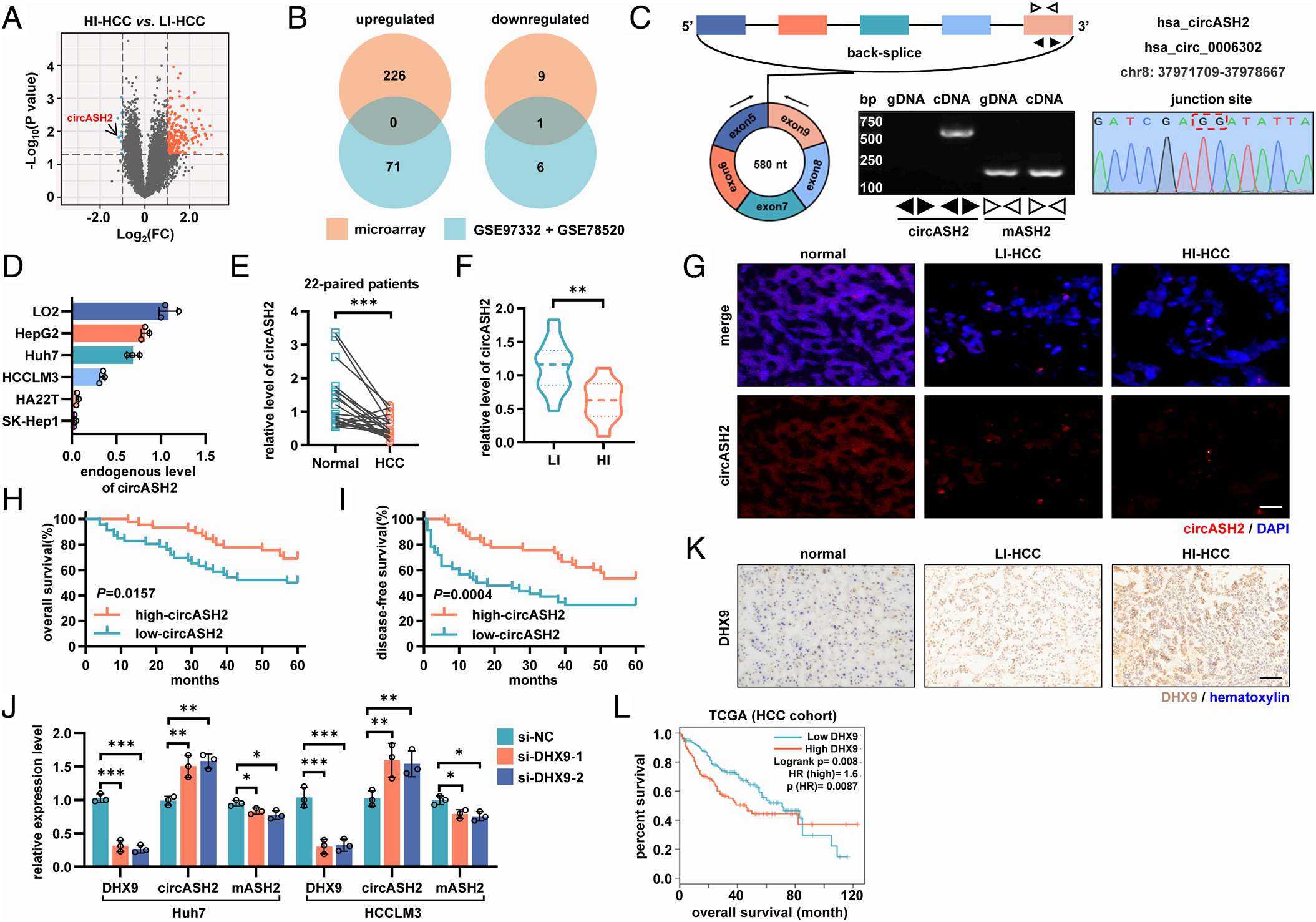 图1 circASH2抑制HCC转移
图1 circASH2抑制HCC转移
cirASH2抑制HCC体内转移
作者对cirASH2在肝癌中的功能进行研究。通过构建三种经典的HCC小鼠模型发现,circASH2过表达抑制了肝脏多灶性病变和肺转移性结节,同时也显著抑制肝转移。这些数据表明,circASH2可以抑制HCC的转移,包括肝内转移、血源转移和植入等。
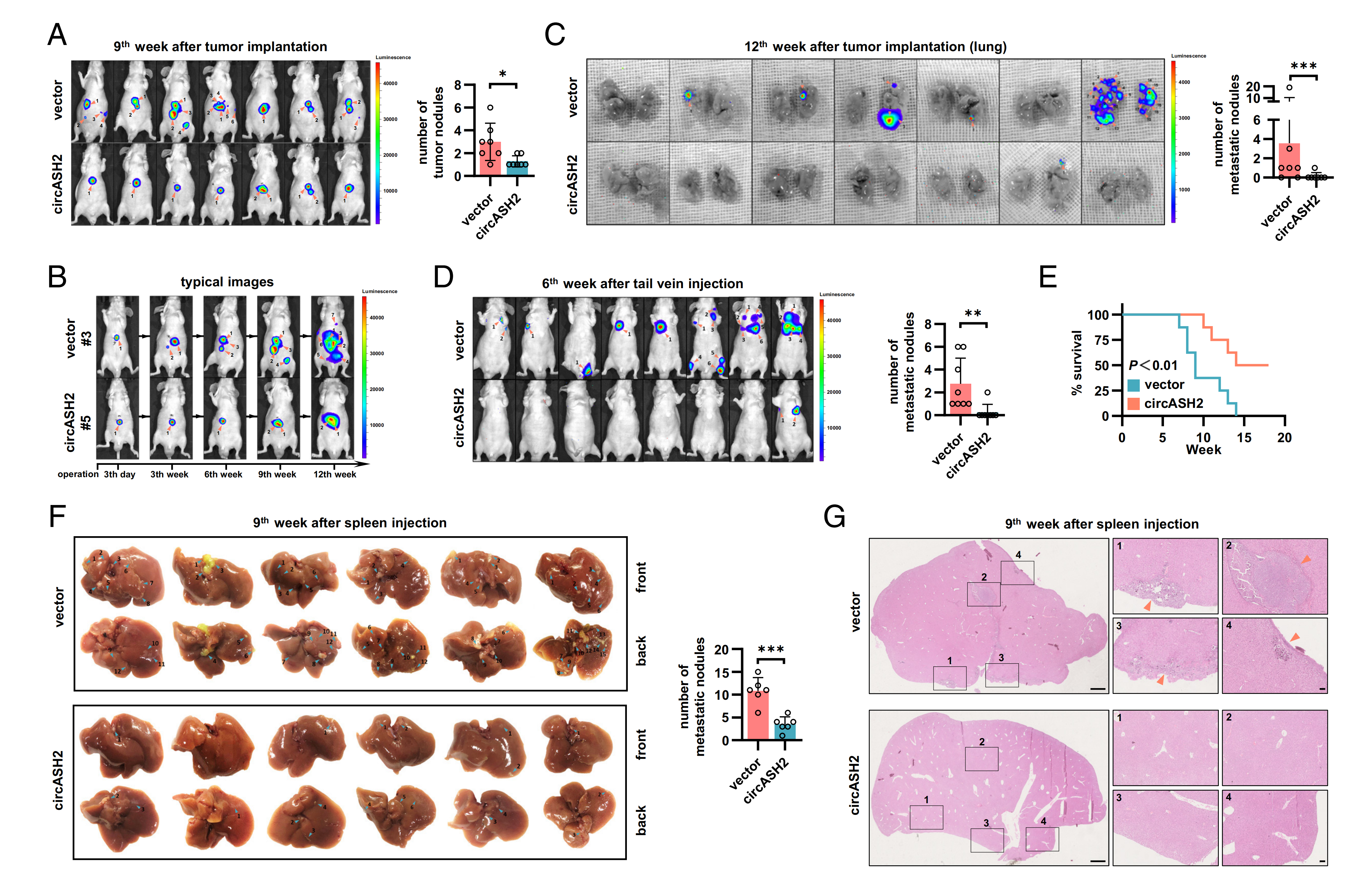 图2 cirASH2抑制体内HCC转移
图2 cirASH2抑制体内HCC转移
circASH2破坏了HCC的细胞骨架组装
作者通过慢病毒过表达、小干扰RNA(siRNA)敲低和反义寡核苷酸(ASO)沉默研究circASH2在HCC细胞中的表达。发现circASH2的过表达可以改变HCC细胞的粘附功能,强烈抑制肿瘤细胞中的F-actin和paxillin,破坏细胞骨架。进一步使用Matrigel构建了三维(3D)侵袭系统发现,circASH2可以通过下调肿瘤细胞的侵袭能力来削弱肿瘤细胞,也降低了HCC细胞的迁移能力。特定ASOs触发的circASH2沉默也会损害细胞骨架组装,并对HCC细胞的迁移表现出促进作用。总体而言,该研究表明circASH2破坏了HCC的细胞骨架组装。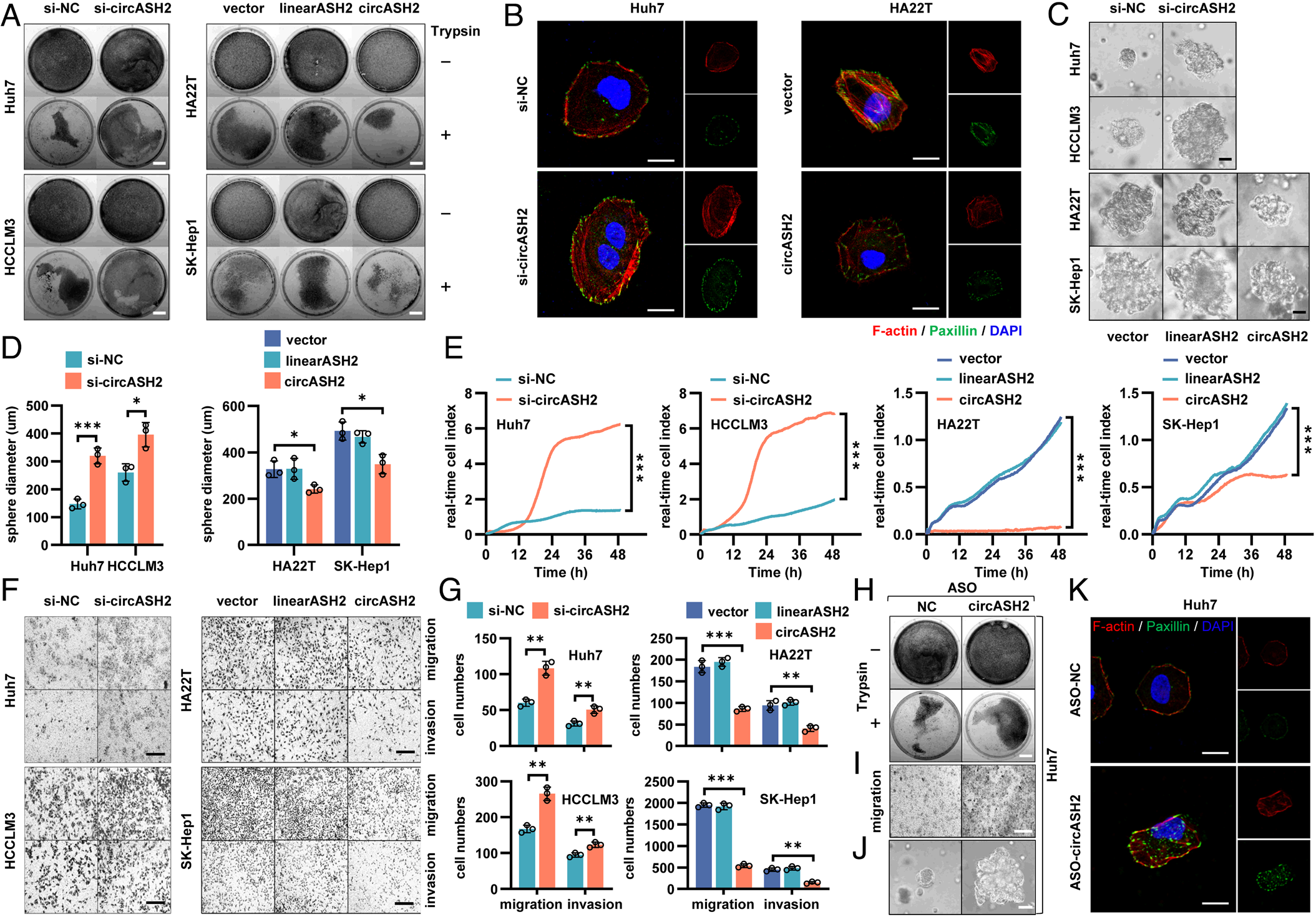
图3 circASH2破坏了HCC的细胞骨架组装
TPM4被circASH2抑制,且与功能相关
细胞骨架状态与细胞粘附、病灶黏附形成和迁移率密切相关。为了阐明 circASH2调控的细胞骨架组装机制,作者对一系列细胞系进行转录组分析。发现TPM4与HCC预后呈负相关。在多个细胞系中进行免疫印迹,验证了circASH2抑制TPM4表达;在患者样本分析中,证实了circASH2的表达水平和TPM4呈负相关。表明circASH2对TPM4有负调控作用。
作者又通过基因集合富集分析了相关通路,结果显示,在circASH2沉默后,FAK通路、PI3K/AKT通路和ECM-受体相互作用通路被显著激活。这些信号的激活可触发一系列的细胞生物学行为,从而导致肿瘤的发生和侵袭。异位TPM4能恢复FAK/PI3K/AKT通路,增强细胞骨架。此外,circASH2抑制细胞的粘附、迁移和侵袭,增强了细胞骨架。使用CRISPR/Cas9系统,在circASH2敲低细胞中删除TPM4时,得出了类似的结论。结果表明,circASH2对TPM4有负调控作用。
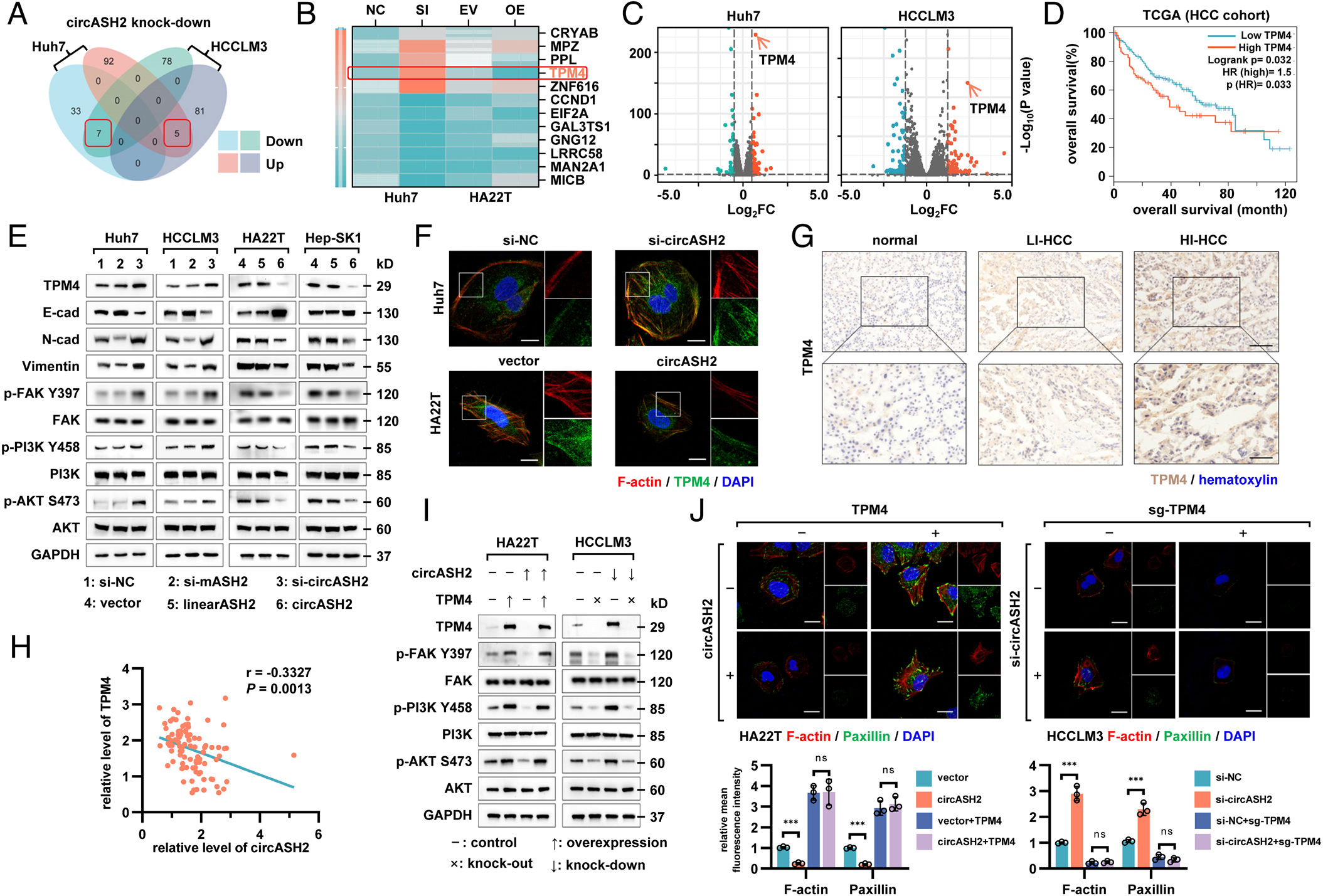 图4 TPM4被circASH2抑制
图4 TPM4被circASH2抑制
circASH2通过物理连接TPM4转录本来促进mRNA衰变
作者为了剖析circASH2调控TPM4的机制,首先通过FISH和核-质分离确定了circASH2主要分布在细胞核中。考虑到TPM4 mRNA和蛋白都被circASH2禁止,作者认为circASH2诱导了对TPM4的转录或转录后调控。当circASH2被调节时,观察到类似的TPM4启动子荧光素酶活性证实了这一点。FISH检测发现,circASH2和TPM4转录本显著共定位。
接下来,作者测试了circASH2和TPM4转录本之间可能的物理相互作用。通过生物素富集分析表明,circASH2不仅可以与TPM4 mRNA结合,还可以与TPM4 pre-mRNA结合。而删除TPM4 mRNA的3‘UTR核苷酸片段(TPM4Δ3’UTR),使TPM4 mRNA与circASH2之间的相互作用明显受损;CDS结构域的缺失(TPM4ΔCDS)也削弱了两者之间的结合。circASH2的突变(circASH2HRmut)完全中止了circASH2和TPM4 mRNA之间的相互作用,减弱了circASH2诱导的降解作用。可预见,circASH2HRmut也失去了削弱肿瘤细胞骨架形成和粘附的能力。结果表明,circASH2可以特异性靶向TPM4转录本并干扰其稳定性。
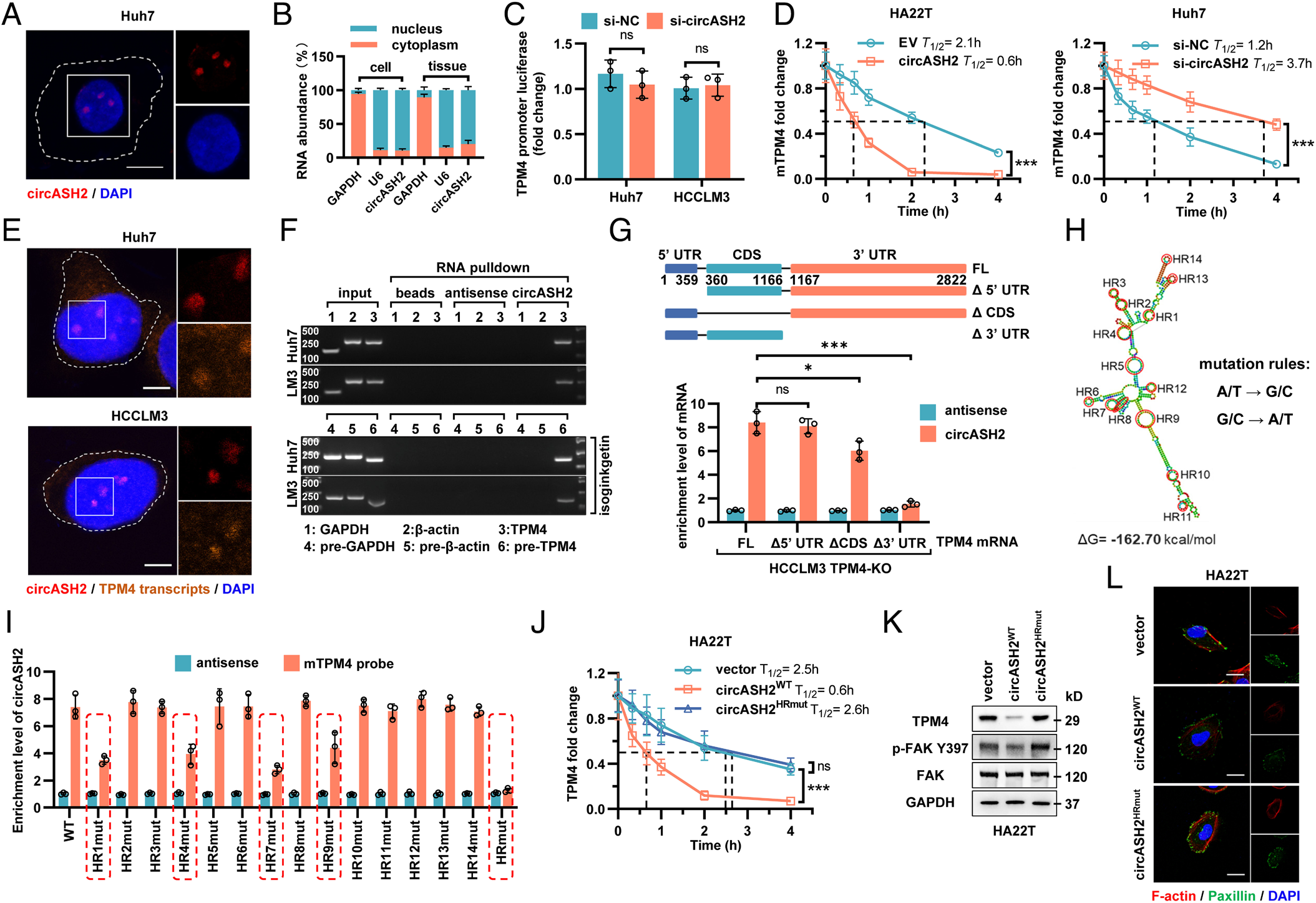 图5 circASH2通过物理连接TPM4转录本来促进mRNA衰减
图5 circASH2通过物理连接TPM4转录本来促进mRNA衰减
circASH2/hnRNP复合物通过无意义介导衰变(NMD)加速mRNA降解
通过质谱分析和基因本体分析发现,circASH2结合蛋白与mRNA的剪接和稳定显著相关,并发现一系列与circASH2有显著结合的hnRNP,表明circASH2可能通过剪接调控干扰TPM4转录本的稳定性。为了验证这一点,作者通过应用三种mRNA剪接抑制剂,发现circASH2诱导的TPM4抑制显著减弱,且呈剂量依赖性。而经历异常剪接的mRNA倾向于进入NMD的过程而不是翻译过程。进一步验证,使用特异性抑制剂阻断了NMD通路或者使NMD关键成分缺失,发现circASH2诱导的TPM4下调受到了抑制。这些数据表明,在HCC细胞中,circASH2诱导的TPM4下调依赖于pre-mRNA剪接和NMD过程,其中hnRNPs复合物作为关键调控因子。
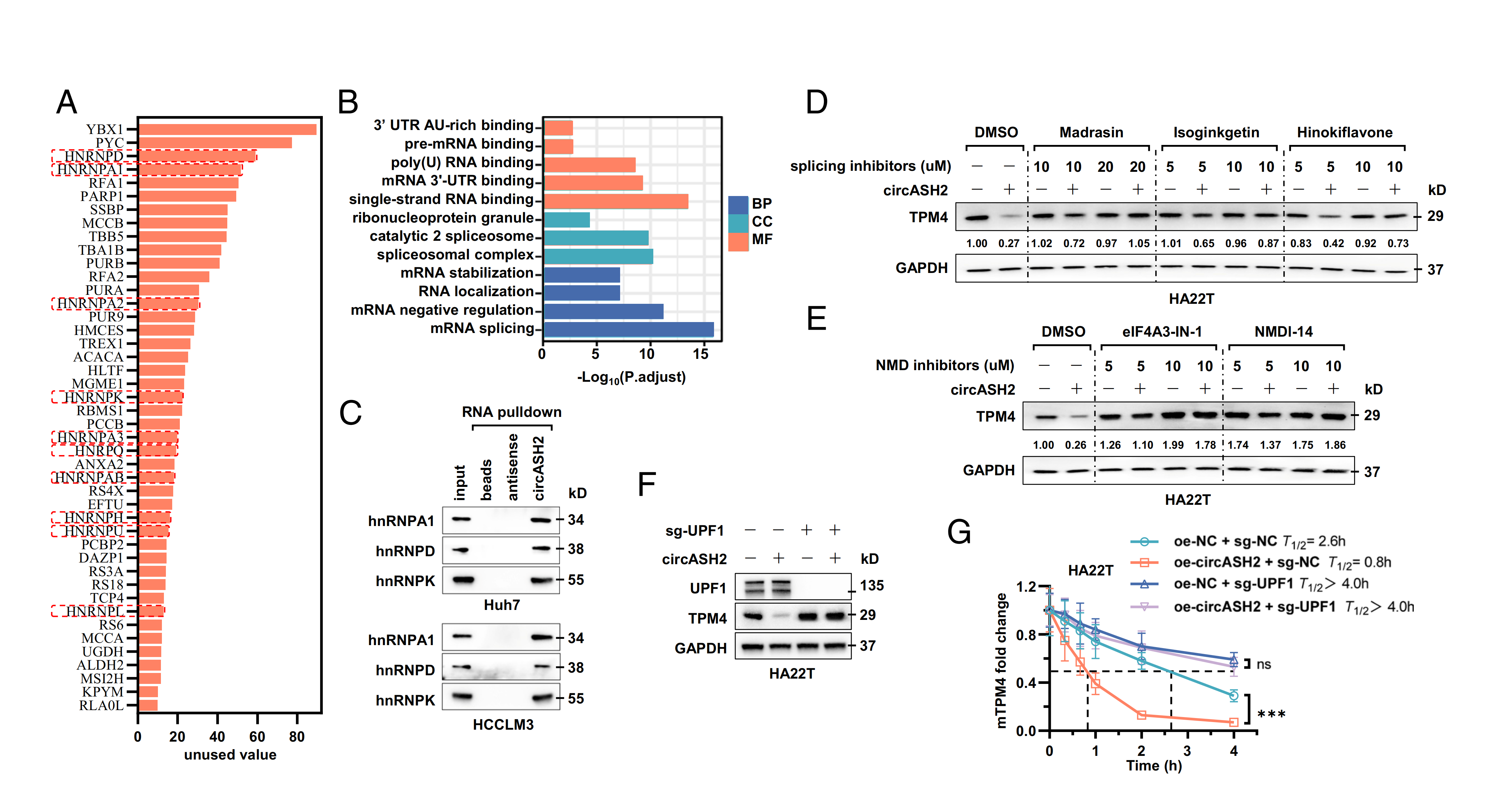 图6 circASH2/hnRNP复合物通过无意义介导衰变(NMD)加速mRNA降解
图6 circASH2/hnRNP复合物通过无意义介导衰变(NMD)加速mRNA降解
circASH2/hnRNP诱导的TPM4 mRNA降解依赖于YBX1
MS分析显示,YBX1是一个众所周知的RBP,涉及pre-mRNA剪接和mRNA衰减,是circASH2结合的首选蛋白,通常与细胞核内的hnRNPs协同作用。在剪接过程中,YBX1可以识别特定的pre-mRNA序列,并招募剪接因子(如hnRNPs)。作者通过circRNA-pulldown免疫印迹、RNA免疫沉淀和共定位染色证实了circASH2和YBX1的相互作用;敲除YBX1完全中止了circAHS2与几种主要hnRNPs之间的连接;YBX1免疫沉淀成功富集了TPM4 mRNA/pre-mRNA,敲低circASH2后这种富集被破坏;YBX1、circASH2和TPM4转录本在HCC细胞核染色图像中严格重叠。
作者进一步研究相互作用机制,发现circASH2的预测结合位点(circASH2YBX1mut)上的突变,在体外内都破坏了与YBX1的连接,也导致circASH2功能丧失。进一步定位实验表明,circASH2的61~64nt、80~84nt和526~530nt区域对YBX1的结合是必不可少的。
YBX1在circASH2/hnRNPs/TPM4轴上具有特征,根据YBX1敲除试验和重组YBX1与circASH2体外结合试验,作者认为circASH2直接与YBX1相互作用,然后招募hnRNPs形成一个功能复合物调节TPM4转录本剪接。
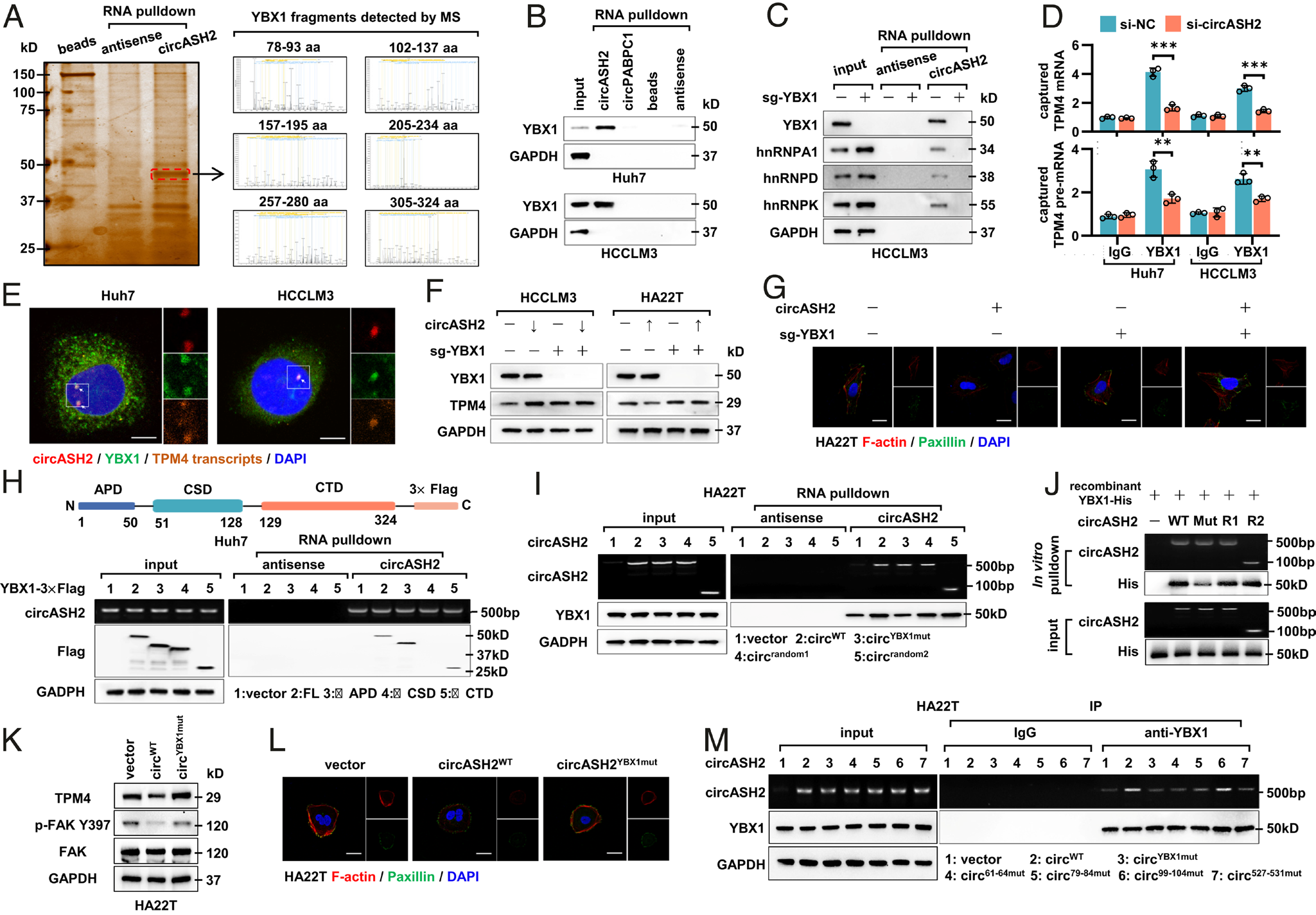 图7 circASH2/hnrnp诱导的TPM4 mRNA降解依赖于YBX1
图7 circASH2/hnrnp诱导的TPM4 mRNA降解依赖于YBX1
核内YBX1经历了由circASH2增强的LLPS
hnRNPs与LLPS密切相关,YBX1形成了斑点并与细胞核中的circASH2和TPM4转录本重叠,而LLPS抑制剂1,6-己二醇会导致YBX1斑点的分解,YBX1在体内经历了LLPS。在体外CTD片段对YBX1的LLPS也是不可或缺的。由此表明YBX1在体内外都能发生LLPS。YBX1的CTD片段作为一个高度无序的区域,是这种生物过程不可缺少的。
在体内,作者发现在circASH2敲低细胞中YBX1点的形成减弱,而过表达的circASH2增加了YBX1点,而circASHYBX1mut没有这样做。在体外,circASH2YBX1-GFP分别与circASH2、circPABPC1和tRNA共培养,只有circASH2成功促进了YBX1的缩合形成。正交实验表明circASH2浓度与YBX1的液滴形成呈正相关。作者研究了YBX1-LLPS是否是circASH2诱导信号和功能的必要条件,发现只有当YBX1保留发生LLPS的能力并与circRNA结合时,circASH2才能抑制TPM4的表达。HCC细胞骨架染色和消化实验一致证实,YBX1-LLPS是circASH2诱导信号的先决条件。
综上所述,circASH2可以加速YBX1 LLPS的发生,这对circASH2-TPM4信号的传递也至关重要。
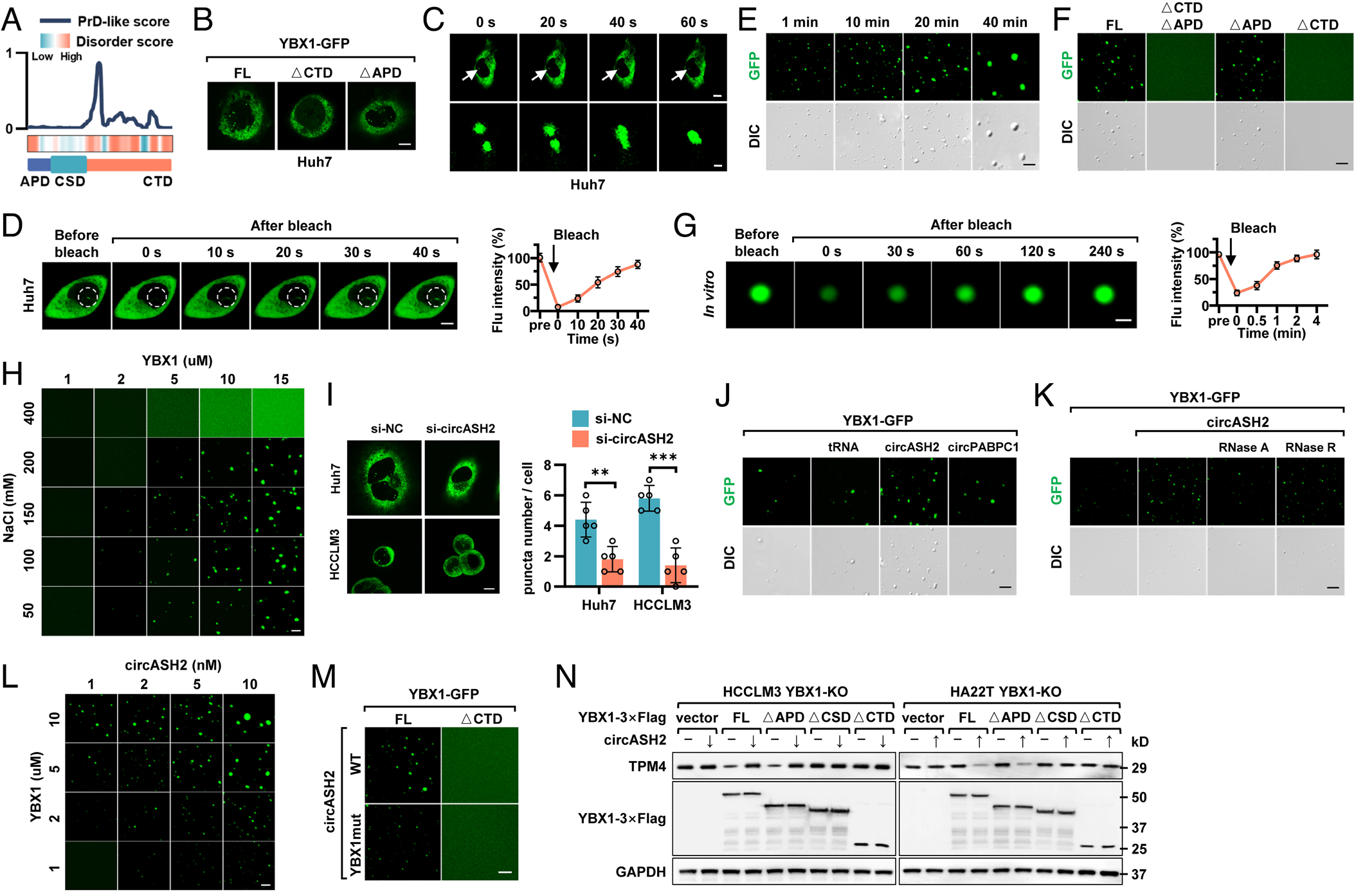 图8 核内YBX1经历了由circASH2增强的LLPS,是circASH2信号不可或缺的
图8 核内YBX1经历了由circASH2增强的LLPS,是circASH2信号不可或缺的
总结
综上所述,核环状RNA circASH2在HCC中表达下调,这与癌细胞经常表现出整体环状RNA丰度减少相一致。更重要的是,circASH2通过抑制TPM4来重塑肿瘤细胞骨架,并在体内外发挥显著的抗转移活性。机制上,circASH2促进了核YBX1的LLPS,并通过与hnRNPs组装复合物来靶向TPM4转录本。这种circRNA/YBX1/hnRNP复合物干扰了TPM4转录本的剪接,并导致其加速降解。此研究提供了一种环状RNA诱导的肿瘤调控机制,它将细胞骨架、mRNA剪接和LLPS联系在一起。随着对circRNA相关药物的开发,此研究将有利于未来的肝癌治疗。
原文链接:
https://www.pnas.org/doi/10.1073/pnas.2220296120?url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org&rfr_dat=cr_pub++0pubmed

.png)
