胶质母细胞瘤(GBM)是最常见的世界卫生组织 IV 级原发性脑癌,即使采用包括手术、放疗和化疗在内的多模式治疗,也几乎无法治愈。研究表明,相当比例的EGFR扩增的GBM肿瘤有异常的MET表达,而激活的MET信号在继发性GBM中更常见,这表明有必要对MET进行深入研究。最近,越来越多的环状RNA(circRNAs)已被证明在人类癌症中产生未被发现的关键靶点,包括GBM。在内部核糖体进入位点(IRES)或N6-甲基腺苷(m6A)修饰的驱动下,circRNAs可以编码功能肽或蛋白质,在自我更新、侵袭和治疗耐药性方面影响癌症干细胞(CSCs)。
2023年7月25日,研究团队在Nature Communications(IF=16.6)发表文章Circular RNA encoded MET variant promotes glioblastoma tumorigenesis。作者发现环状MET RNA(circMET)编码一个由N6-甲基腺苷(m6A)阅读器YTHDF2促进的404个氨基酸的MET变体(MET404)。circMET的基因消融可抑制小鼠中MET404的表达,并减弱MET信号传导。MET404直接与MET β亚基相互作用,并形成一个组成性激活的MET受体,其活性不需要HGF刺激。MET404高表达预示GBM患者预后不良,提示其临床相关性。文章揭示了circMET编码一种蛋白MET404,并揭示了MET404驱动肿瘤发生的精细调节机制。
中山大学附属第一医院张弩教授、陆军医大学西南医院病理研究所及西南肿瘤中心时雨副教授、北京大学生命科学学院白凡研究员、南京医科大学汪秀星教授为共同通讯作者。中山大学第一附属医院钟键博士、WuXujia、GaoYixin、ChenJunju为共同第一作者。
circMET是m6A修饰的潜在编码的circRNA
许多蛋白质编码的环状RNA是由m6A修饰驱动的。为了发现m6A修饰的环状RNA,作者对10个GBM样本进行了RNA-seq和m6A-seq,结合核糖体RNA数据库(Bowtie220)和参考基因组(HISAT221)分析,确定了剪接位点内独特的锚定位置。然后通过find_circ来识别环状RNA,共鉴定出1425个m6A修饰的环状RNA。另外,发现m6A修饰的环状RNA更可能由单个外显子产生,并且在癌组织中表达更高。KEGG富集分析也表明m6A修饰的环状RNA的源基因在多种RTK通路中富集。
接下来作者为了揭示具有编码潜力的环状RNA,利用RNC-seq和find_circ鉴定了GSCs和对照神经干细胞(NSCs),共鉴定出共鉴定了1605个差异表达的RNC-circRNA。为了进一步缩小GSCs中可翻译的环状RNA,将GSCs进行RIP-seq,与上述m6A-seq和RNC-seq结果进行交叉引用,鉴定出了5个候选的环状RNA,作者考虑到MET在GBM肿瘤发生中的关键作用,所以将重点放在circMET(hsa_circ_0082002)上进行研究。
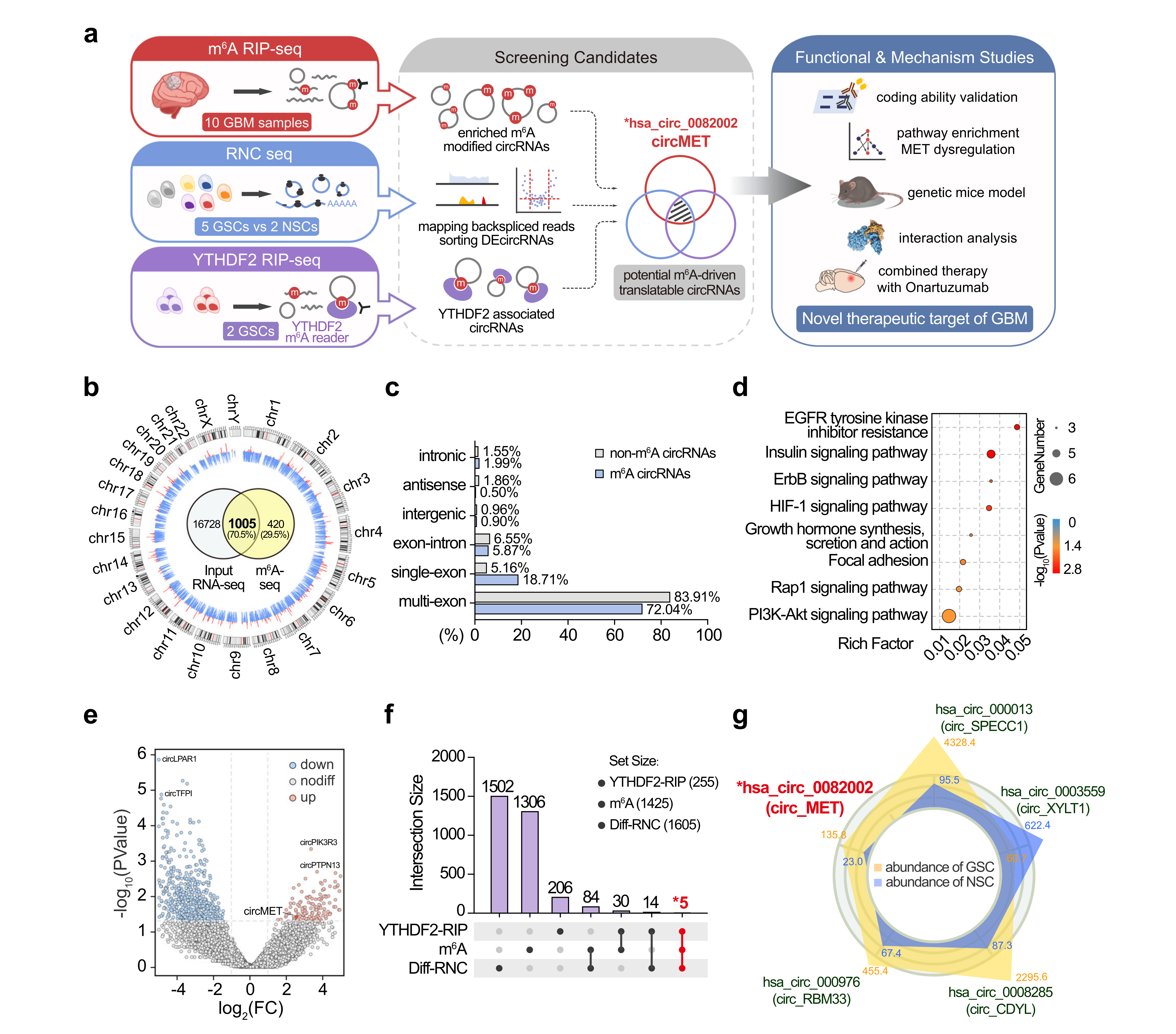 图1 circMET是经过m6A修饰的潜在编码的circRNA
图1 circMET是经过m6A修饰的潜在编码的circRNA
circMET由m6A阅读器YTHDF2驱动编码MET404蛋白
circMET由hMET基因的第2外显子形成,作者使用连接特异性引物验证了circMET(1214 nt),以及对RNase R消化的抗性。circMET包含一个跨物种保守的ORF,该蛋白在人类和小鼠中编码一个404个氨基酸(a.a.)蛋白。作者通过CRISPR/Cas9系统生成circMET敲除(KO)小鼠,并显著降低了circMET水平。在circMET KO小鼠多个器官中MET404表达显著减少,而MET表达未受影响,表明circMET编码了MET404蛋白。
circMET是一种m6A修饰的、YTHDF2相关的circRNA,YTHDF2是一种有效的GBM高表达的胶质瘤预后标志物。所以作者研究YTHDF2对circMET的翻译是否影响,在GSC细胞中敲除了(KD)YTHDF2,发现YTHDF2 KD不影响circMET的表达,但降低了MET404蛋白水平。此外,通过RIP实验表明,YTHDF2突变体W432A和W486A不能与circMET相互作用,因此没有改变MET404蛋白的表达。研究发现,与MET相比,MET404在一些GSCs和GBM癌组织中表达水平相当甚至更高。GBM样本的免疫组化(IHC)显示,MET404表达与YTHDF2表达存在空间相关性,MET404高表达预示GBM患者总生存率较差。
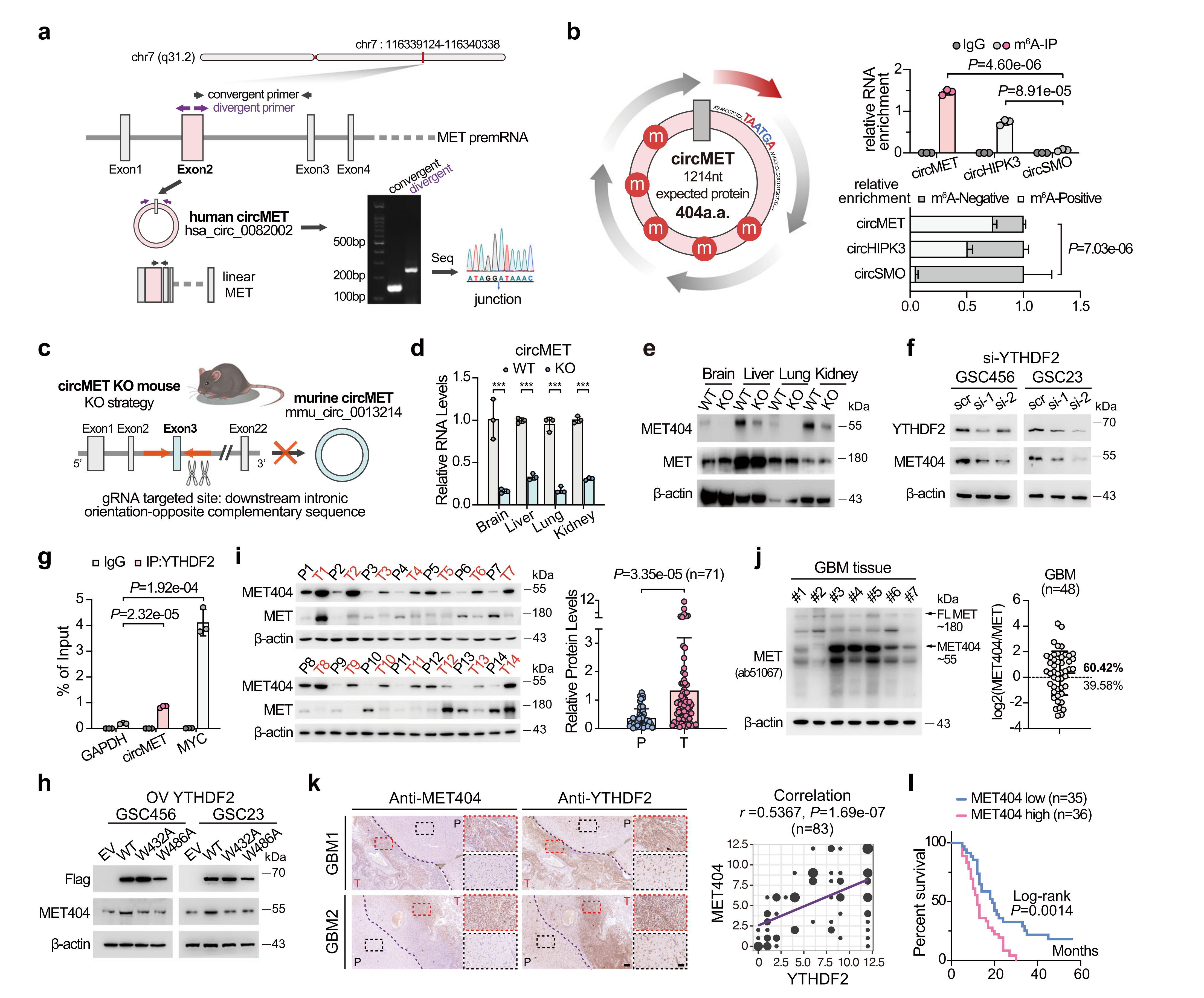 图2 circMET由m6A阅读器YTHDF2驱动编码MET404蛋白
图2 circMET由m6A阅读器YTHDF2驱动编码MET404蛋白
MET404通过激活MET信号通路促进GBM肿瘤的发生
为了探索MET404的未知功能,作者通过构建过表达或敲低circMET的GSC28细胞的RNA-seq,KEGG富集分析发现MET404参与了多种癌变信号通路。接着作者检测了相关信号通路蛋白表达,发现稳定的circMET KD GSC456和GSC23细胞中,p-MET及其下游p-AKT,p-ERK显著抑制;细胞增殖、有限稀释试验和神经球形成能力试验显示,两种类型的circMET KD GSCs均受到抑制;而在GSC28细胞中,呈现相反的结果。
作者在小鼠上进行了验证,MET404的KD抑制了小鼠脑肿瘤异种移植物的生长并延长了总体生存期。了解到MET404激活的p-AKT可以模拟PTENf/-,作者构建了P53f/f;R26-MET404-flagLSL/+;GFAP-Cre转基因小鼠(MET404 KI小鼠)。大多数MET404 KI小鼠在20周时发生了脑肿瘤,肿瘤表型与GBM非常相似,具有高度激活的MET信号。与对照组小鼠(P53f/f;R26-MET404-flag+/+;GFAP-Cre,MST 48.35周,常死于皮下肿瘤)相比,MET404 KI小鼠的总生存期明显较短(MST 29.25周,均死于中枢神经系统肿瘤)。以上结果表明,MET404通过激活MET信号通路对GBM肿瘤发生至关重要。
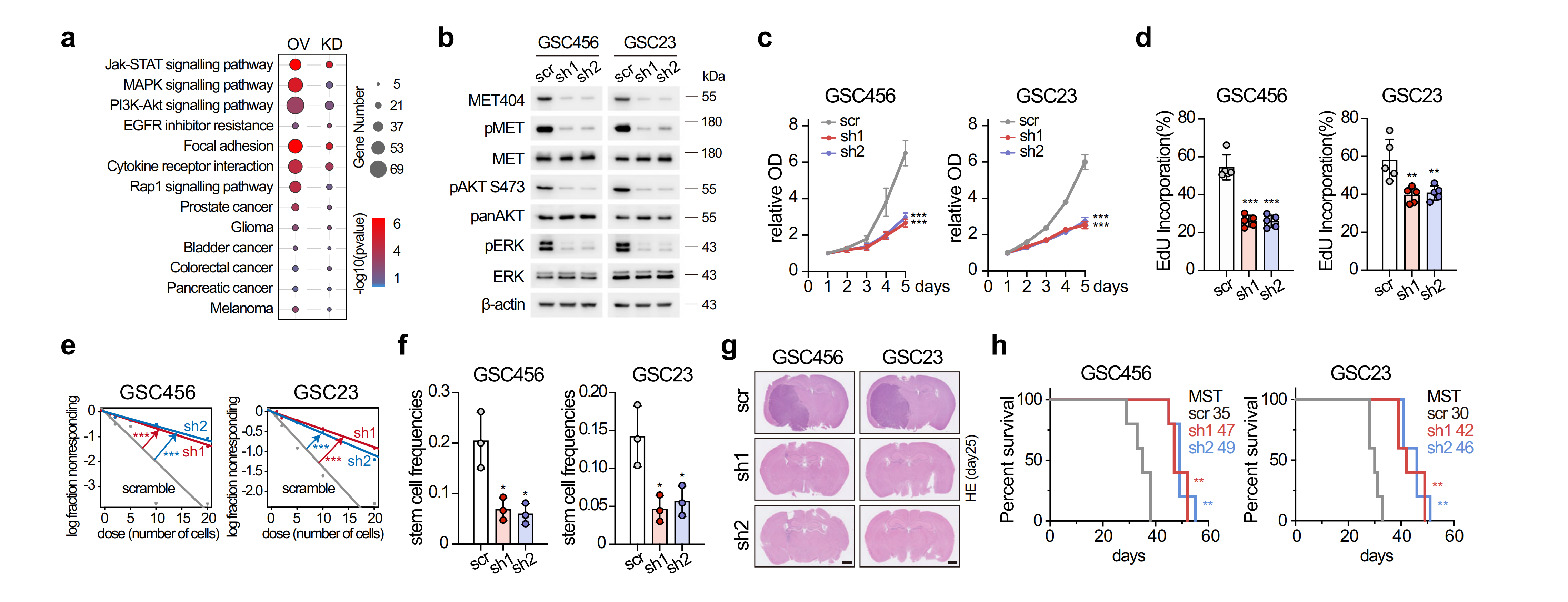 图3 MET404通过激活MET信号通路促进GBM肿瘤的发生
图3 MET404通过激活MET信号通路促进GBM肿瘤的发生

图4 在基因小鼠模型中MET404的条件性敲入启动GBM
MET404通过与METβ亚基相互作用来激活MET受体
作者对MET404激活MET信号通路的机制进行研究,发现MET404能被分泌到GSC培养基中,并且纯化后的MET404能激活MET和下游信号传导,这些效应可以通过添加MET404中和抗体来拮抗。在GSC28和GSC387细胞中,MET受体的稳定KD抑制了纯化的MET404诱导的MET的激活和下游信号转导。上述结果表明,MET404通过MET受体发挥作用。
接着作者通过IP-MS实验、分析及Reactome通路分析显示,MET404相互作用蛋白与RTK、MET信号通路高度相关。然后利用STRING数据库,建立蛋白相互作用网络。通过IP和IF验证了GSC23细胞中MET404/MET的相互作用。上述结果表明,MET404是一种与MET相互作用的分泌蛋白。
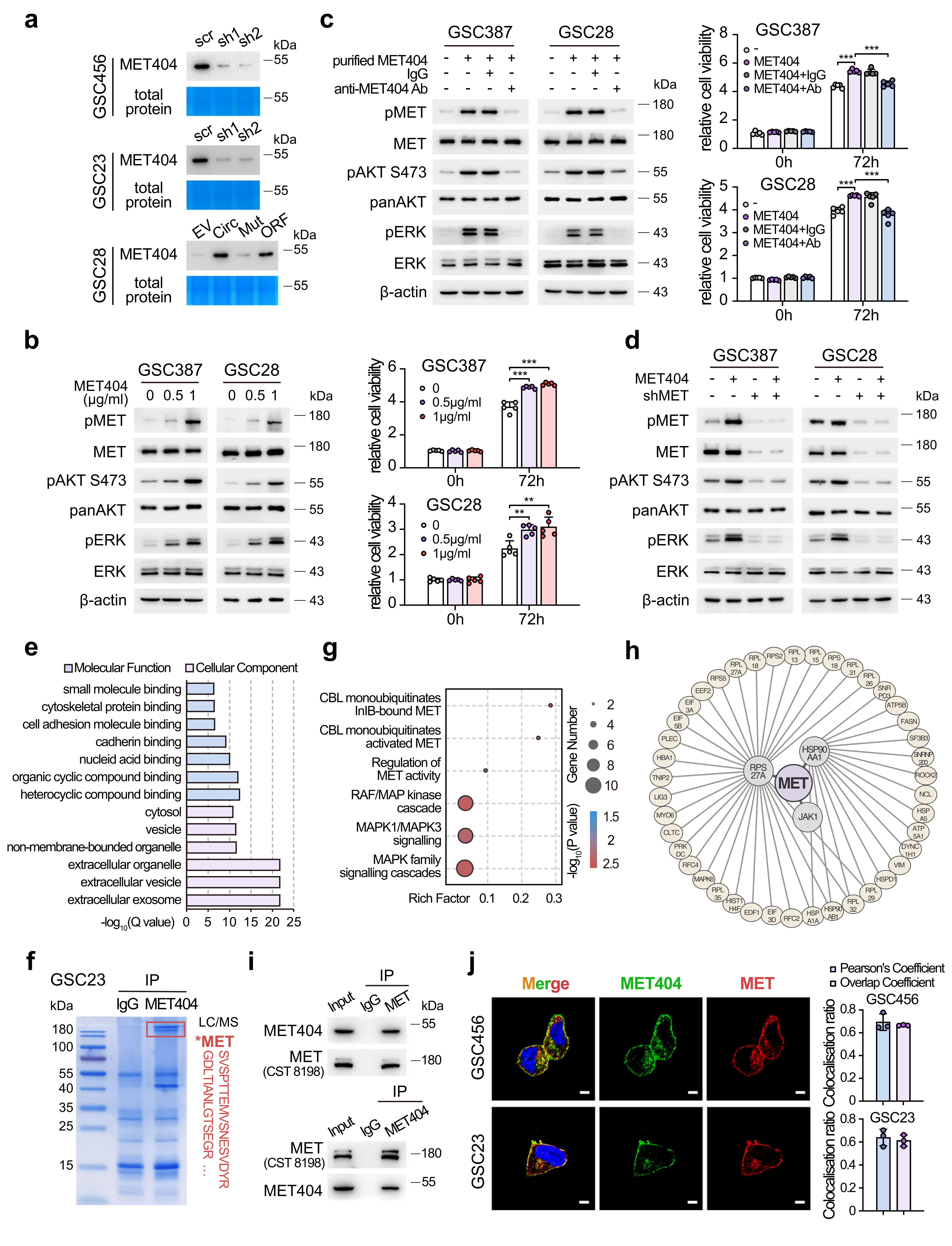 图5 MET404是一种与MET相互作用的分泌蛋白
图5 MET404是一种与MET相互作用的分泌蛋白
为了阐明MET404/MET受体结合位点,作者首先使用ClusPro服务器模拟了由MET404和MET外域形成的复合物,发现MET上的542-650残基(跨越MET39的PSI和IPT1结构域)是介导其与MET404相互作用的关键。由此合成了全长MET受体和构建了几个截断的MET受体结构域,发现MET404与MET受体的PSI+ IPT1结构域相互作用,并且MET404和HGF联合处理对p-MET的活化有协同作用,但MET404比HGF的优先级更高。
紧接着作者发现MET404可以在不需要HGF的情况下独立激活p-MET,而RTK的激活需要在配体结合时发生二聚反应。由此进一步通过HA或标记MET单体,并使用相应的标记抗体进行COIP检测,发现在对照组细胞中观察到不同标记的MET之间的相互作用(表明二聚体),并能通过添加纯化的MET404得到加强。综上所述,HGF和MET404独立激活MET受体,并协同作用以最大限度地传递MET信号。
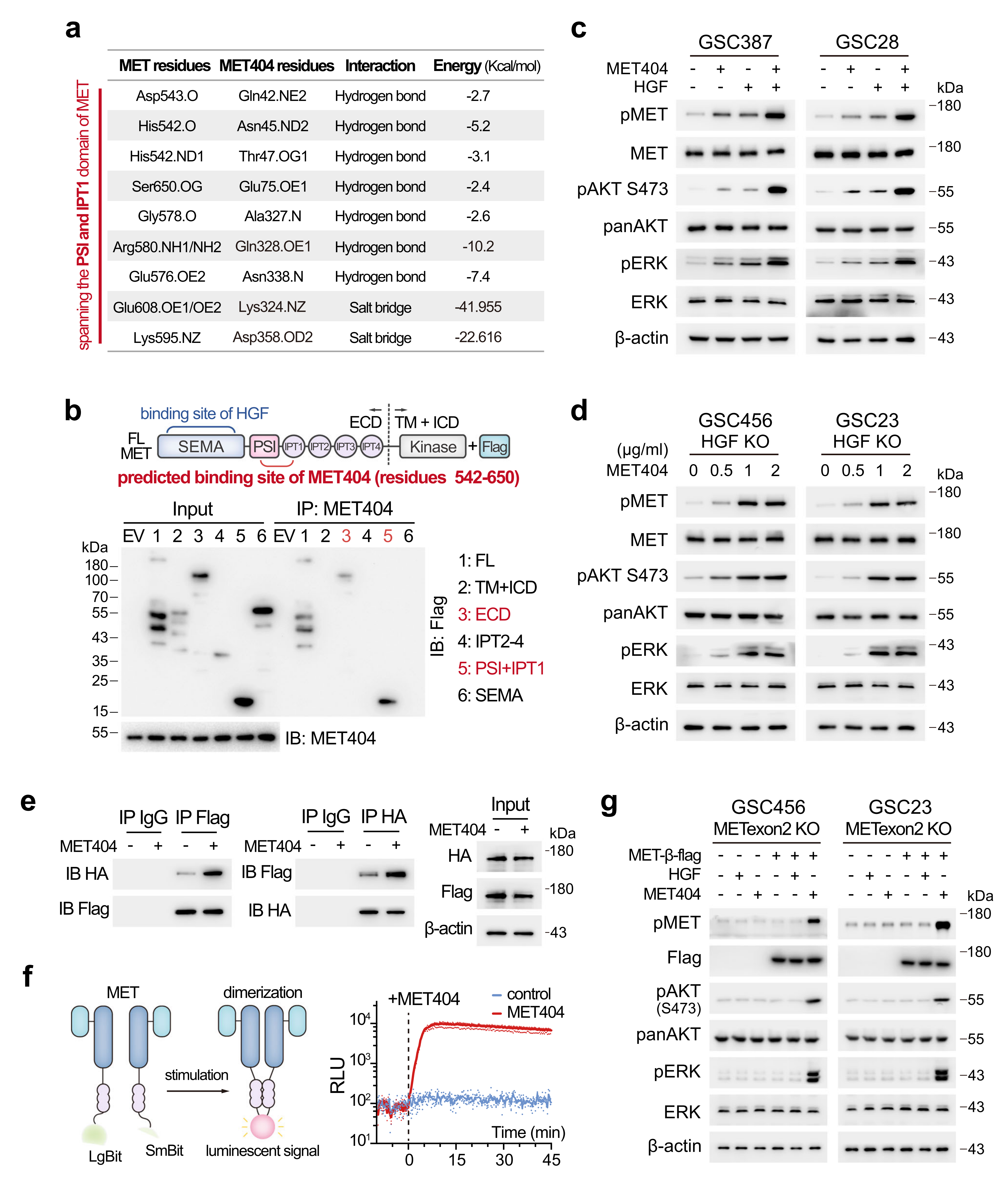 图6 MET404可独立激活MET受体
图6 MET404可独立激活MET受体
靶向MET404和奥纳妥珠单抗抑制GBM进展的协同作用
在GBM临床样本中,作者通过IF观察到明显的MET404和p-MET共定位,并且MET404强度与p-MET水平相关。此外,p-MET水平与GBM中MET404表达的相关性强于与MET受体表达的相关性,即MET404是GBM中p-MET的主要激活因子。而MET-404抗体的剂量依赖性添加逐渐降低了GSC23和GSC456细胞中的p-MET水平,提示在GBM中靶向MET404的临床潜力。MET404抗体和奥纳妥珠单抗的联合使用能够最大限度地抑制了GBM进展和体内MET信号传导,并延长了实验小鼠的总生存期。
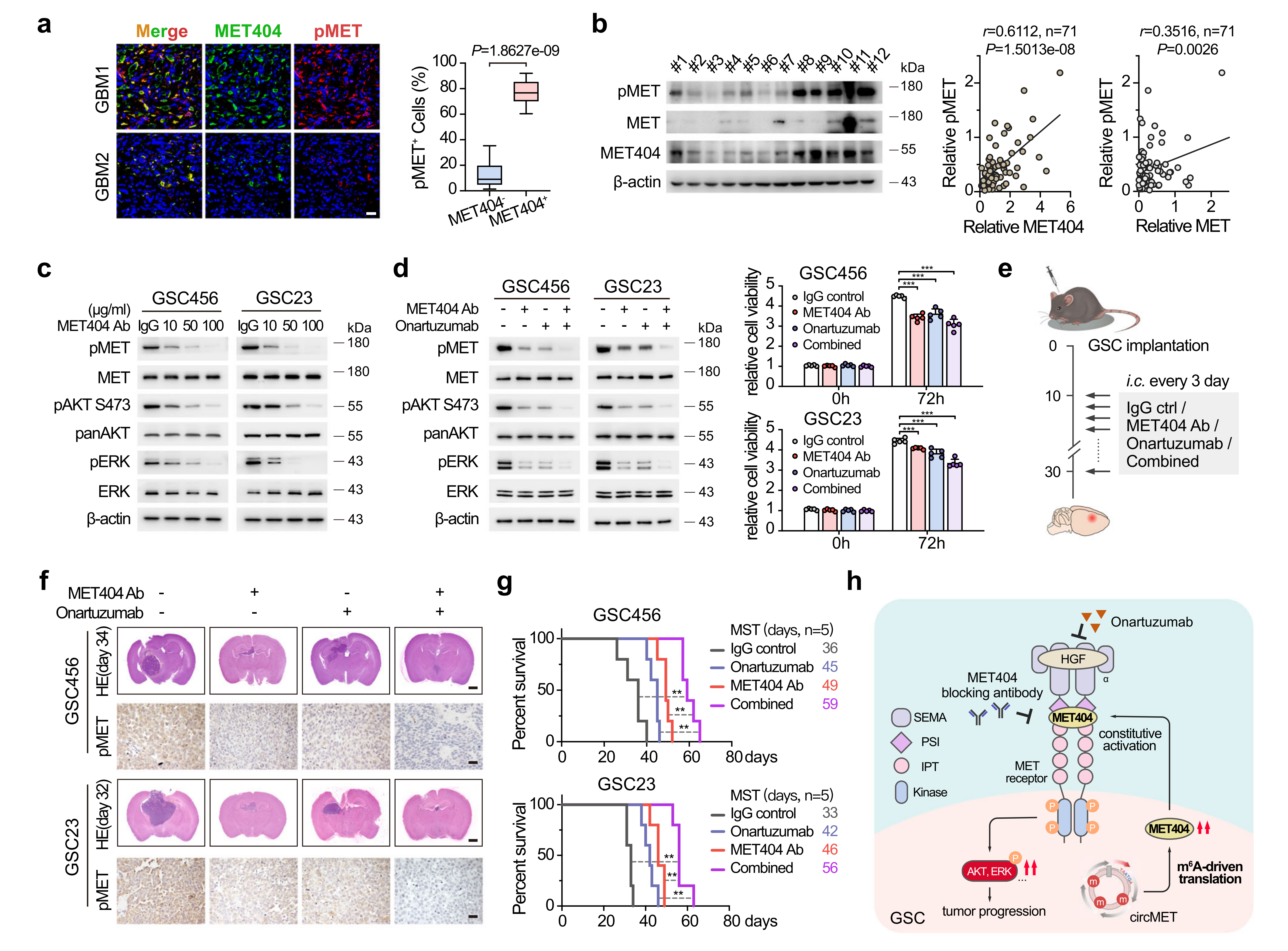 图7 靶向MET404和奥纳妥珠单抗抑制GBM进展的协同作用
图7 靶向MET404和奥纳妥珠单抗抑制GBM进展的协同作用
总结
总的来说,本文确定了GBM中一个由circMET生成的分子靶点MET404。作为一种先前未知的MET配体,MET404组成性地激活MET受体,刺激不依赖于HGF的下游效应因子,并驱动GBM的肿瘤发生。用单克隆抗体靶向MET404增强了抗HGF/MET治疗的疗效,凸显了一种可转化的脑恶性肿瘤关键节点治疗策略。
原文链接:
https:/https://www.nature.com/articles/s41467-023-40212-1
.png)
