创新治疗 时代已至
合成工艺 稳中求进
 图1:mRNA与circRNA人工合成流程
图1:mRNA与circRNA人工合成流程
In Vitro Transcription, IVT
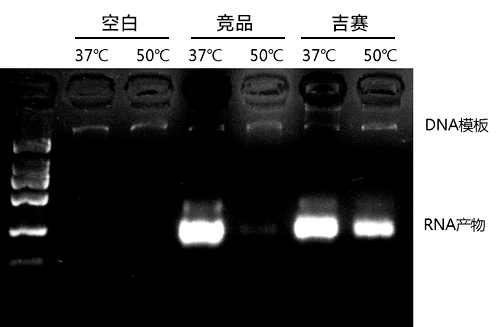
图2:50℃条件下保持强耐热性并高效转录
 图3:合成300~6000nt长度的转录本时保持优良的转录效果
图3:合成300~6000nt长度的转录本时保持优良的转录效果
Circularization
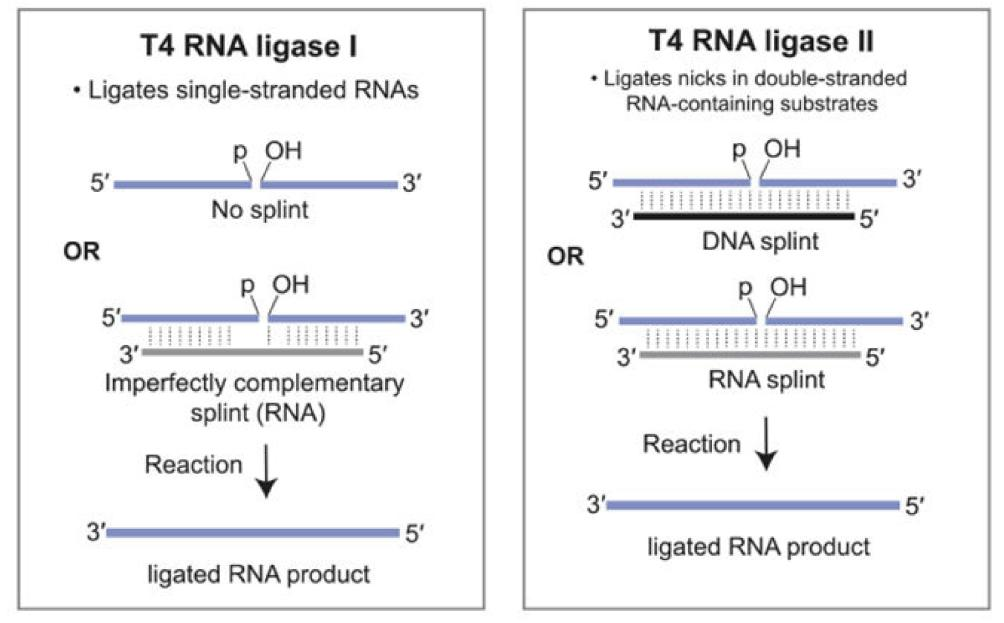 图4:T4 RNA Ligase 1和T4 RNA Ligase 2的连接原理
图4:T4 RNA Ligase 1和T4 RNA Ligase 2的连接原理
T4 RNA Ligase 1「吉赛生物R0502」,是一种可以催化ssRNA、ssDNA或单核苷酸分子间或分子内形成连接的酶。T4 RNA Ligase 2「吉赛生物R0503」,是一种可以催化dsRNA分子内环化连接和分子间线性连接的酶。T4 RNA Ligase 2与T4 RNA Ligase 1不同的是,对dsRNA中的Nick的连接活性要大大高于对ssRNA末端的连接活性,因此借助RNA二级结构使RNA分子内连接成环通常采用T4 RNA Ligase 2 。
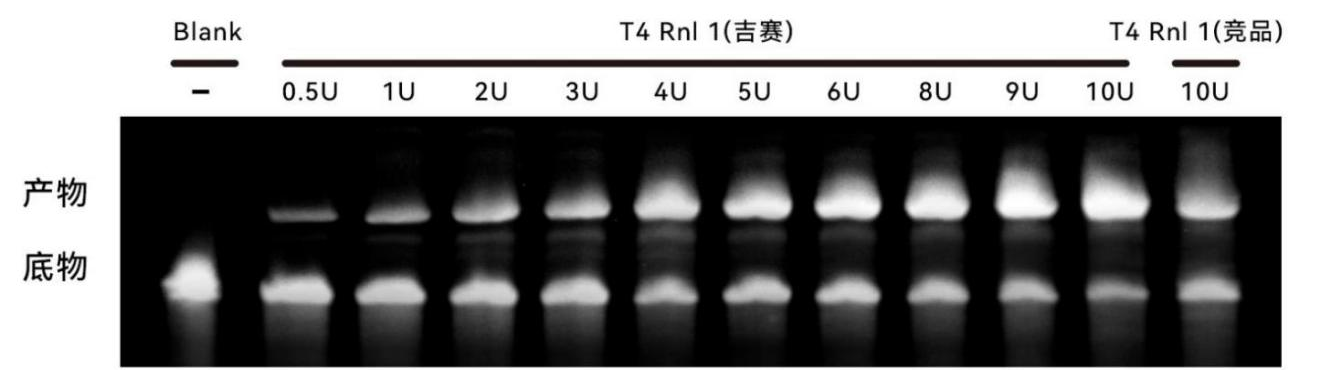
图5:更优的催化效果和更高的连接效率
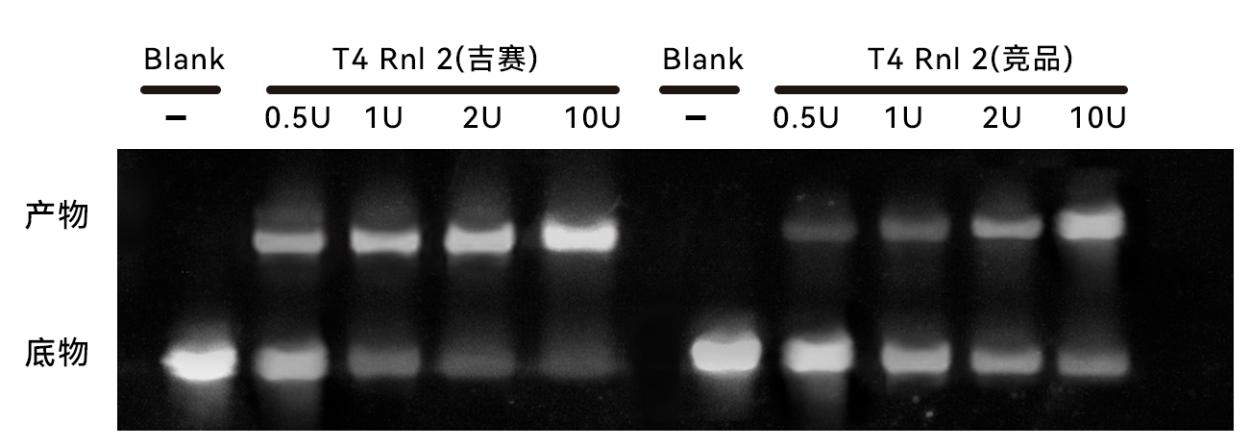 图6:更高的连接效率,仅需1U即有明显的连接效果
图6:更高的连接效率,仅需1U即有明显的连接效果
ssRNA Cyclase是一种耐热连接酶,环状RNA合成试剂盒「吉赛生物R0501」可催化ssDNA和ssRNA的环化,能生产用于滚环复制或滚环转录实验或NGS的单链DNA模板以及合成小于500nt的circRNA。
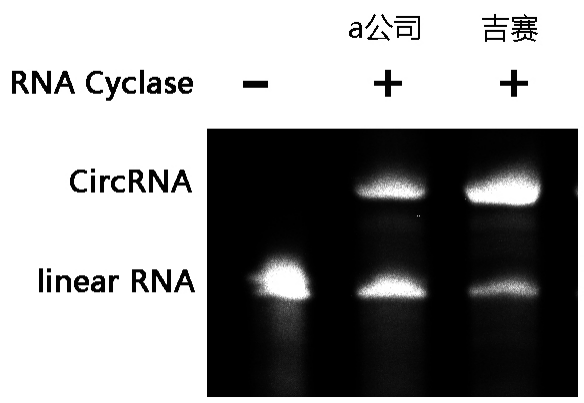
图7:45℃孵育60 min,可将85%以上的ssRNA转化为circRNA
Purification
消除线性RNA残余的干扰,是获得高纯度circRNA的关键。circRNA耐受RNase R消化,高效的RNase R「吉赛生物R0301」可以完全清除线性RNA,RNase R不仅是连接酶法circRNA人工制备的关键原料,在内含子自剪切策略中也是必不可少的。
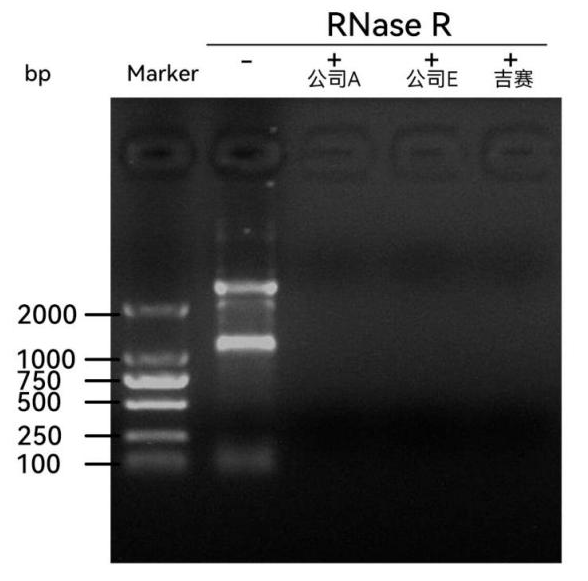 图8:37℃孵育15min,吉赛与国外知名竞品消化效果相当
图8:37℃孵育15min,吉赛与国外知名竞品消化效果相当
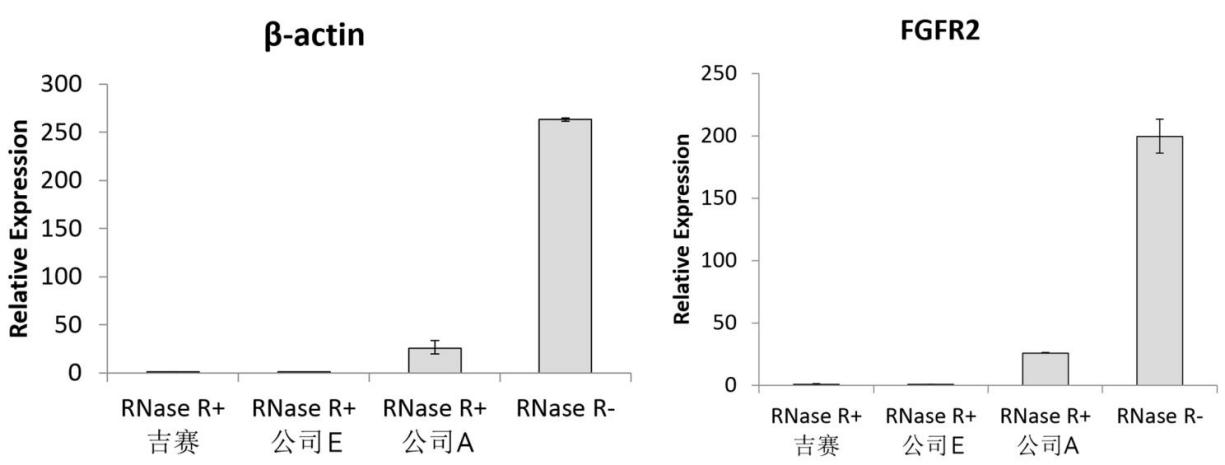 图9:37℃孵育30min,吉赛消化效果与国外知名竞品E相当,优于竞品A
图9:37℃孵育30min,吉赛消化效果与国外知名竞品E相当,优于竞品A
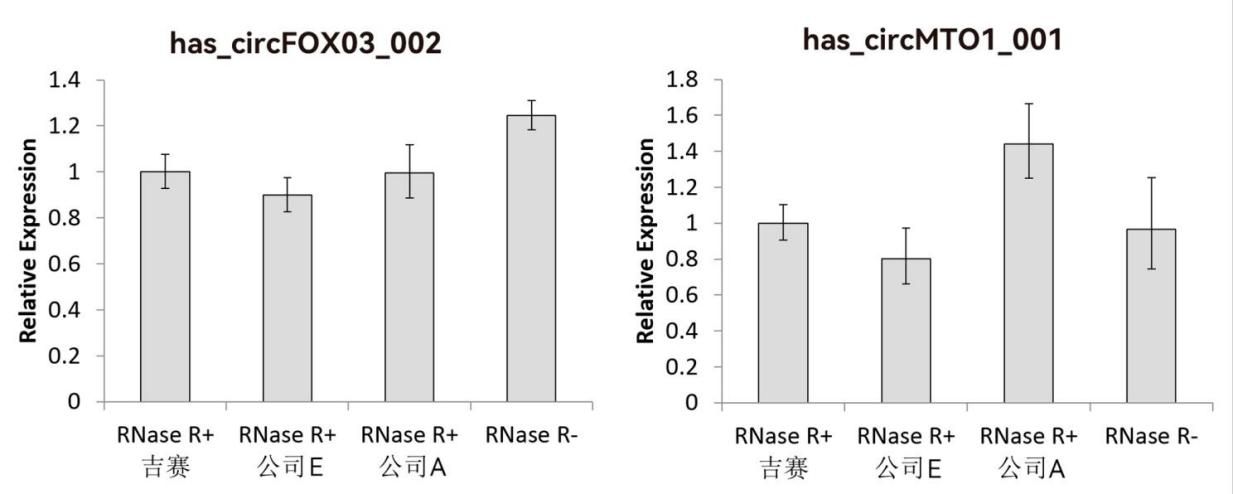 注:数据计算以“RNase R+吉赛”组为对照,设定其相对丰度值为1。
注:数据计算以“RNase R+吉赛”组为对照,设定其相对丰度值为1。
图10:37℃孵育30min,吉赛与国外知名竞品富集效果相当
随后,通过层析等工艺进一步纯化,获得的纯化产物便可进入制剂环节。
知识产权 加速布局
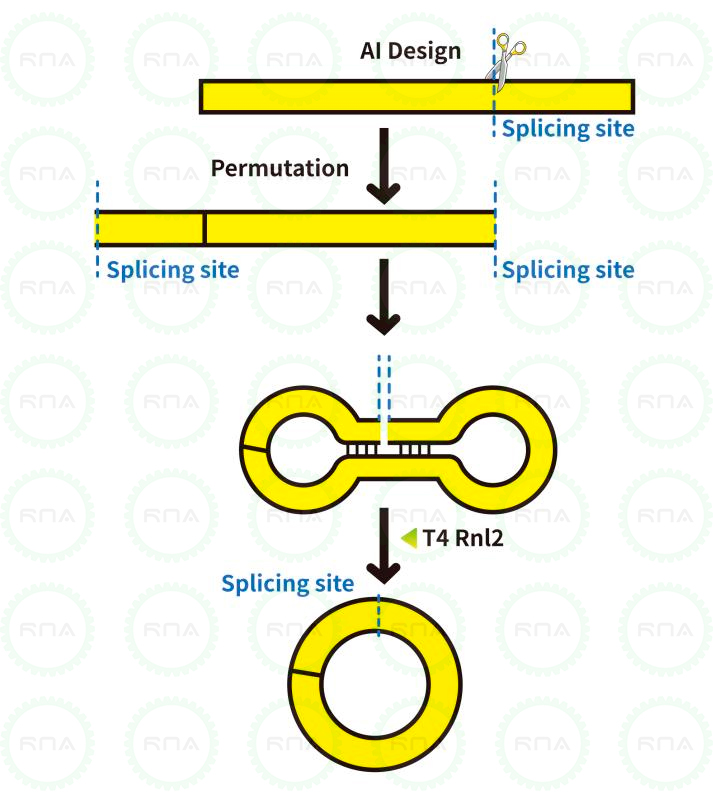
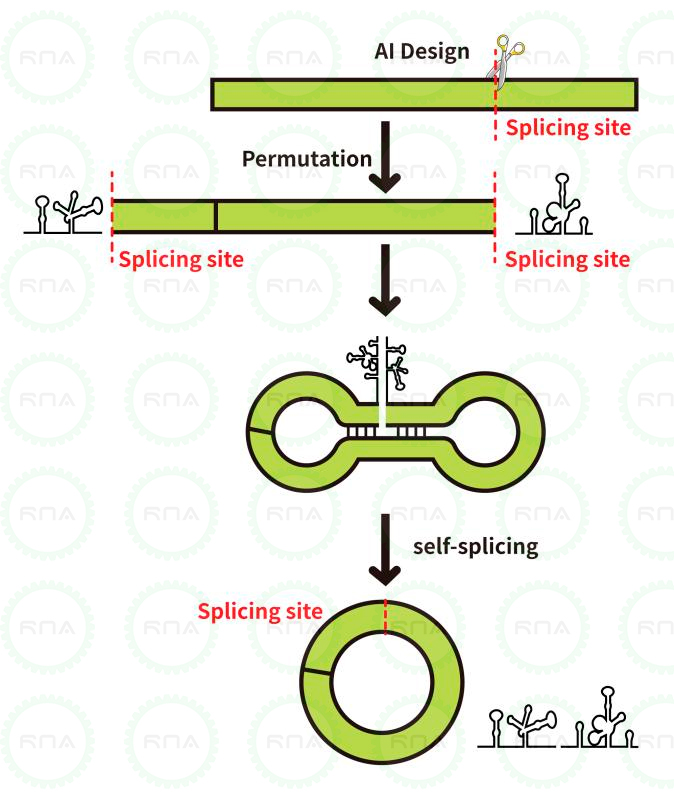
图11:吉赛生物环化策略circPure™和circPrecise™
定制型的原液生产 ,可以根据已被挖掘的治疗靶点进行抗原设计,开展早期验证以推进下一步大规模工业化制剂; 预制型的标准品 「吉赛生物R0701-04/R0801-04」,可以作为早期探索的阳性对照,用于 翻译表达验证 、 转染递送评估 、 工艺流程优化 等领域。
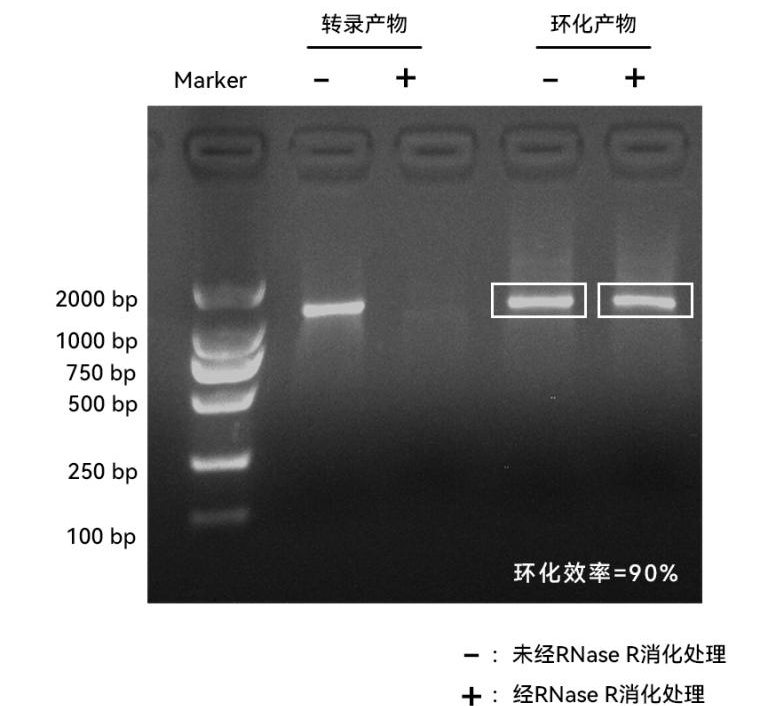
图12:制备效率可达90%
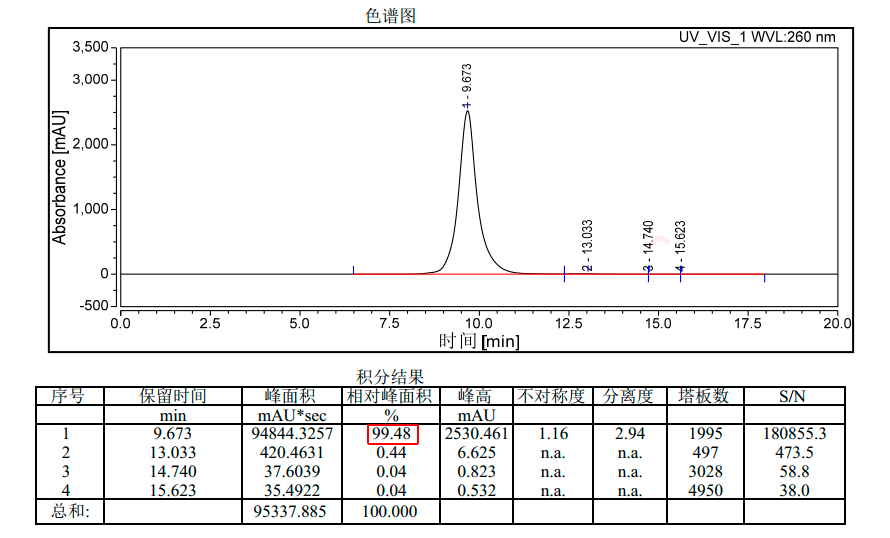
图13:制备纯度可达99%
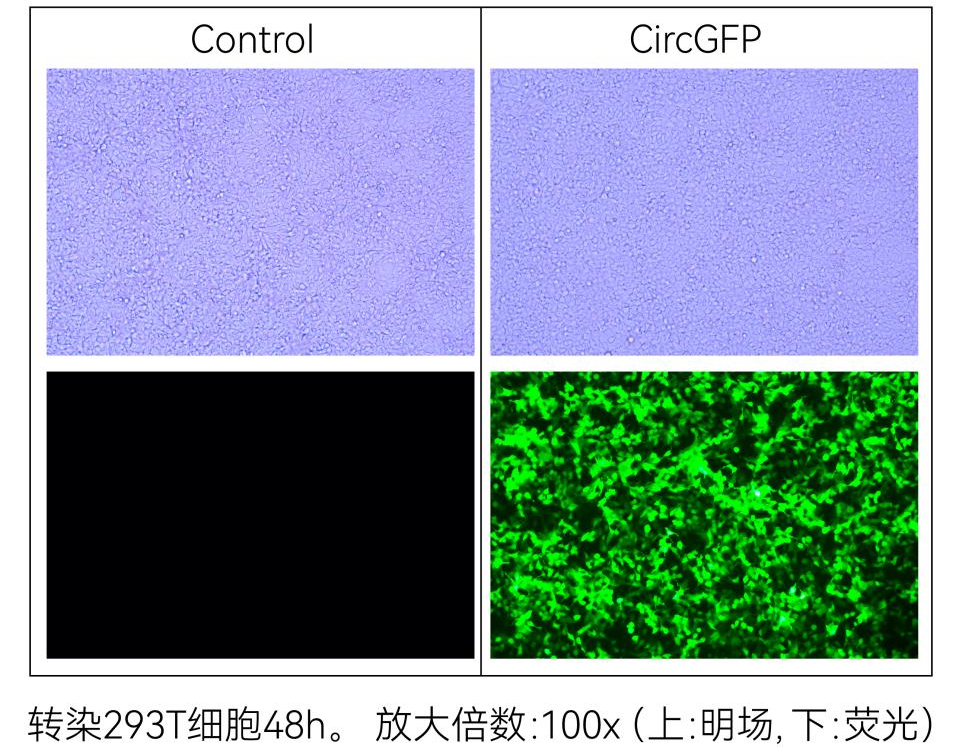
图14:circPure™和circPrecise™体系预制标准品CircGFP荧光显微镜拍照
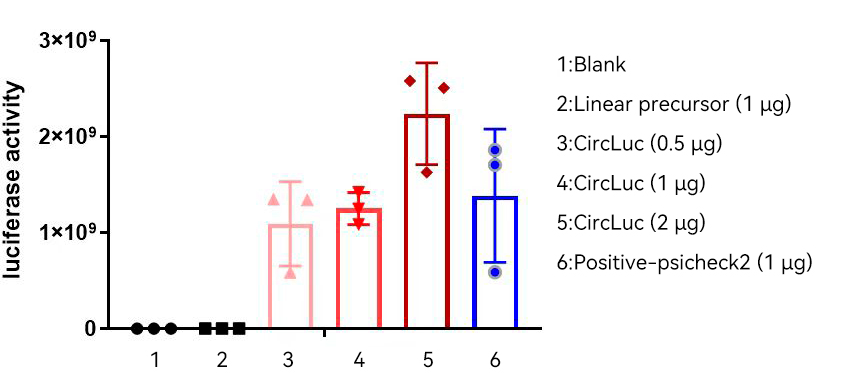
图15:circPure™和circPrecise™体系预制标准品CircLuc荧光素酶检测
千亿赛道 未来可期
.png)