3月4日,Nature Cell Biology杂志发表了一篇circRNA翻译的重要进展,报道E-Cadherin基因形成的circRNA(circ-E-Cad)可以翻译蛋白,在胶质母细胞瘤(GBM)中表达上调,显著促进GBM进程。文章的通讯作者是中山大学附属第一医院张弩教授与美国西北大学程世源教授。

circRNA翻译蛋白已经有一定体量的研究报道,是生物医学研究领域的一支潜力股,这篇NCB文章的发表再次印证了这一点。本文作者通过高通量RNA-seq测序结合Ribosome Profiling翻译组学测序,在GBM标本中发现经典的上皮细胞标志物E-Cadherin来源的circRNA(circ-E-Cad)在GBM中显著升高,具备翻译的潜能。经过定制抗体,质谱鉴定证明了翻译产物(C-E-Cad)的存在。机制方面,作者发现C-E-Cad可以结合并独立激活EGFR/EGFRvIII,靶向C-E-Cad的抗体可以阻断这一效应。GBM中circ-E-Cad上调,并持续翻译出C-E-Cad,C-E-Cad分泌至胞外后通过激活EGFR/EGFRviii。裸鼠原位成瘤模型结果显示,抗EGFR治疗和抗C-E-Cad联合治疗可显著抑制肿瘤进程,延长裸鼠生存期([1])。本文的结果表明有抑癌作用的基因来源的circRNA也可以具有促癌的效果。该发现也增进了EGFRviii突变型激活机制的认识, 是circRNA翻译产物机制研究的重要进展。
GBM中circ-E-Cad表达升高,有翻译潜能
针对12对GBM癌与癌旁配对的组织标本进行高通量RNA-seq测序,10对GBM癌与癌旁配对的组织标本进行Ribosome Profiling测序。分析GBM癌与癌旁差异表达的circRNA,同时与Ribosome Profiling数据进行交叉,分析有潜在翻译能力的差异表达circRNA分子。分析的结果中发现E-Cadherin基因来源的一个circRNA(circ-E-Cad)在潜在翻译的circRNA中差异最显著,在GBM组织中表达上升。circ-E-Cad由E-Cadherin基因的7-10外显子构成,长度733nt。circ-E-Cad耐受RNase R消化,定位在细胞质中,在NSC中没有表达,但在CD133阳性的GSC干细胞中表达显著升高。而母基因E-Cadherin在GSC细胞中表达非常低。circ-E-Cad在GBM标本中表达显著高于癌旁组织。

图1 GBM中基于RNA-seq和Ribosome Profiling发现circ-E-Cad ([1])
circ-E-Cad翻译254aa的蛋白C-E-Cad
上述实验从Ribosome Profiling数据中分析到了circ-E-Cad,说明该circRNA可能具有翻译潜能。序列分析表明,circ-E-Cad的ORF跨过接口位点,编码254aa的序列(C-E-Cad),其中1-240aa与E-Cadherin的母蛋白(NP_004351)282-682序列一致,末尾有14个氨基酸是C-E-Cad独有的。针对这一段氨基酸序列构建定制化单克隆抗体。在H2S细胞中过表达C-E-Cad和空载体组均检测到25kD左右的单一条带。GSC细胞系中通过CD133富集后的细胞,CD133阳性的细胞中C-E-Cad表达显著,CD133阴性的细胞表达较低。GBM标本中也检测到病人标本中C-E-Cad表达显著升高。GBM标本免疫组化检测表明癌组织中C-E-Cad表达显著高于癌旁组织。生存分析表明,高表达C-E-Cad的患者预后更差。此外,病人标本中同步检测C-E-Cad和SOX2显示,C-E-Cad表达与SOX2有较高的相关性。
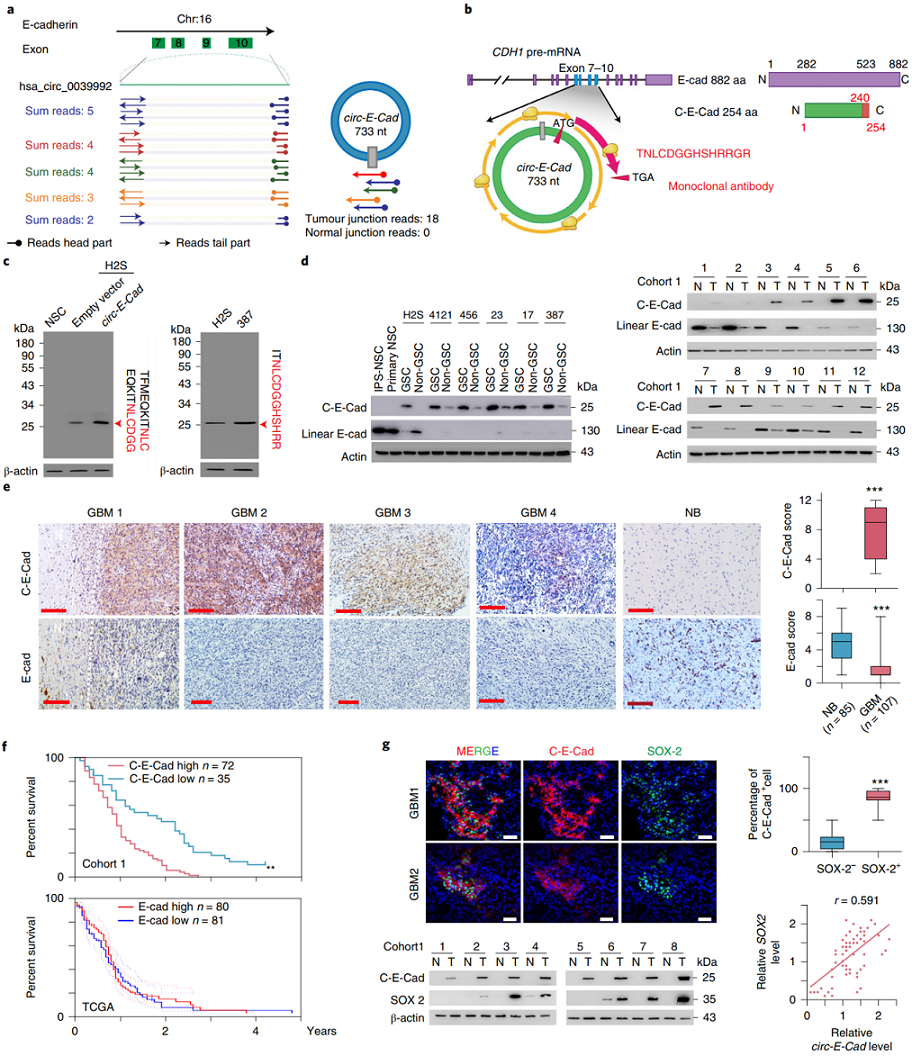
图2 circ-E-Cad翻译254aa的蛋白C-E-Cad ([1])
体外和体内C-E-Cad调控GSC的自我更新,促进肿瘤进程
C-E-Cad与SOX2表达的高相关性暗示C-E-Cad可能与GSC的干性调控有关。为此,GSC387中干扰circ-E-Cad,GSCH2S中过表达circ-E-Cad或C-E-Cad ORF,通过WB检测GSC干性和分化的标志基因,结果表明干扰circ-E-Cad后C-E-Cad表达下调,同时,GSC干性相关的基因表达下降,分化标志物表达上升,说明干扰circ-E-Cad后促进GSC的分化。过表达circ-E-Cad或C-E-Cad ORF均促进GSC的干性和c-Myc表达。LDA分析,EdU掺入效率分析,脑片浸润深度分析结果显示,C-E-Cad具有促进GSC干性维持和肿瘤进程的作用。颅内成瘤结果显示,干扰circ-E-Cad可抑制肿瘤生长速度,过表达circ-E-Cad或C-E-Cad ORF均促进颅内肿瘤生长速度,降低生存期。

图3体外体内分析C-E-Cad ORF 对GSC干性和肿瘤进程的作用 ([1])
GSC中C-E-Cad促进STAT3,PI3K/Akt,MAPK通路
Gene Set富集分析显示,GSC387和GSC4121细胞中稳定干扰circ-E-Cad后STAT3直接调控的下游基因构成的基因集有显著变化,说明circ-E-Cad有激活STAT3的作用。WB实验证明circ-E-Cad显著促进STAT3磷酸化,同时Akt,Erk的磷酸化状态也受到正向调控。GSC细胞中敲除E-Cadherin后回补表达C-E-Cad ORF也可以直接激活STAT3通路。LDA,EdU掺入效率分析及颅内成瘤实验证明了E-Cadherin敲除后过表达C-E-Cad ORF可以促进细胞干性,自我更新和成瘤速度。

图4 GSC中C-E-Cad调控STAT3通路 ([1])
C-E-Cad可分泌至胞外,通过EGFR激活STAT3通路
活细胞成像显示C-E-Cad融合mCherry后分析定位,发现C-E-Cad可分泌至胞外。从多种GSC细胞培养上清的浓缩液中可检测到C-E-Cad。GSC培养体系中添加体外纯化的C-E-Cad及中和抗体,结果显示,单独添加C-E-Cad能增加细胞的干性,中和抗体阻断这一现象。STAT3激活的主要分子途径包括EGFR,MET,PDGFA和IL-6R,分别对这些受体蛋白进行RNAi,看添加C-E-Cad前后STAT3激活的情况,结果表明EGFR干扰后,添加C-E-Cad不再显著激活STAT3,其他通路没有这一变化,说明C-E-Cad主要通过EGFR通路实现STAT3的磷酸化激活。GSC387细胞中稳定敲低EGFR后回复表达野生型和1068A突变体,WB检测添加C-E-Cad后下游通路的变化情况,结果显示稳定敲低内源EGFR后过表达Y1068A突变体(该突变体不能正常激活下游通路),添加C-E-Cad不再激活下游STAT3通路,说明C-E-Cad主要通过EGFR发挥作用。

图5 C-E-Cad通过EGFR激活STAT3通路 ([1])
C-E-Cad结合EGFR
上述实验表明C-E-Cad可以通过EGFR激活STAT3通路,那么C-E-Cad是直接结合EGFR还是通过其他方式?CoIP实验显示C-E-Cad能够与EGFR结合,共定位实验,Docking比对分析,SPR分子互作分析均证明C-E-Cad可以结合EGFR。EGFR分段截短后CoIP分析表明,EGFR的CR2结构域是C-E-Cad结合EGFR的主要区域。Docking分析表明,C-E-Cad分子结合EGFR的区域主要集中在C-E-Cad的C端。体外纯化N端不同长度的片段,添加到H2S细胞和E-Cadherin敲除细胞中,分析STAT3磷酸化状态,结果显示,C端14aa的区域突变后不再具有激活STAT3的作用。这些实验说明C-E-Cad主要通过其C端14aa的位点结合EGFR,激活STAT3。

图6 C-E-Cad可结合EGFR ([1])
C-E-Cad单独结合并激活EGFR和EGFRvIII突变体
GBM中广泛存在一种特殊的EGFR突变体:EGFRvIII突变体。该突变体缺少胞外的EGF结合结构域,目前广泛使用的EGFR靶向药物对这种突变体没有效果,EGFRvIII突变体在GBM中的作用机制也不是很清楚。上述的实验表明,C-E-Cad可结合EGFR的DR2结构域,该结构域在EGFRvIII突变体中依然保留,那么是否C-E-Cad可以作为EGFRvIII突变体的特殊配体呢?在GSC和E-Cadherin敲除细胞中,分别处理C-E-Cad和EGFR,看下游STAT3随时间推移,其磷酸化水平的情况。结果表明EGF刺激后45min STAT3的磷酸化水平迅速下降,但C-E-Cad刺激后STAT3的磷酸化水平一直维持。文献报道表明EFGR激活后会迅速通过内吞机制降解失活,EGF处理后时间梯度分析也显示,45min左右出现显著的p-EGFR的内吞现象。但C-E-Cad处理后不会出现这种变化,磷酸化的EGFR会一直停留在细胞表面,说明C-E-Cad激活EGFR的机制与EGF不同。GSC细胞中敲除E-Cadherin同时敲除EGFR,然后回补野生型EGFR和EGFRvIII突变体,WB检测STAT3磷酸化,结果表明,单独回补野生型EGFR或EGFRvIII突变体均可促进STAT3的磷酸化,一起表达则更加显著的促进STAT3的磷酸化水平。CoIP实验证明C-E-Cad可以结合野生型EGFR或EGFRvIII突变体。稳定敲低EGFR的细胞中回补EGFRvIII突变体,同时敲低C-E-Cad后STAT3磷酸化水平显著下降。GSC细胞中敲除E-Cadherin同时敲除EGFR,分别回补野生型EGFR,EGFRvIII突变体,通过14aa突变前后的C-E-Cad处理,发现,C-E-Cad可以在回补野生型EGFR,EGFRvIII突变体时均激活STAT3,但14aa突变后,不再激活EGFRvIII突变体。

图7 C-E-Cad单独结合并激活EGFR和EGFRvIII突变体 ([1])
C-E-Cad中和抗体与EGFR靶向单抗协同抑制GBM颅内成瘤
GBM临床标本中检测显示,C-E-Cad阳性的区域STAT3激活频率显著升高。标本生存分析显示,EGFR阳性的GBM如果同时C-E-Cad阳性的,生存期显著变差。尼妥珠单抗(nimotuzumab,N_mab)是已知的靶向EGFR的抗体类药物,GBM颅内成瘤的裸鼠模型中分别用N_mab,C-E-Cad中和抗体(C-E-Cad antibody)接两者联合处理,三天一次给药,分析肿瘤大小和生存期,结果显示,C-E-Cad中和抗体和N_mab可协同抑制GBM颅内肿瘤的生长速度

图8 C-E-Cad中和抗体与EGFR靶向单抗协同抑制GBM颅内成瘤 ([1])
本文的工作详细探索了circ-E-Cad编码蛋白C-E-Cad在GBM中的作用机制,并在颅内原位成瘤模型中验证了C-E-Cad中和抗体可与EGFR靶向单抗尼妥珠单抗协同抑制肿瘤的生长,为今后开发靶向这一靶点的抗体药物提供了依据。
参考文献
1. Gao, X., Xia, X., Li, F. et al. Circular RNA-encoded oncogenic E-cadherin variant promotes glioblastoma tumorigenicity through activation of EGFR–STAT3 signalling. Nat Cell Biol (2021). https://doi.org/10.1038/s41556-021-00639-4
.png)