骨髓造血干细胞(HSCs)每天生产超过一万亿个细胞。 HSCs分化成各种祖细胞,然后再形成许多类型的髓系和淋系细胞。 这个过程需要严格调节基因的表达。转录因子,长非编码RNA(lncRNAs)和microRNAs(miRNAs)都有助于其分化。除miRNA和lncRNA外,还有其他非编码RNAs(如circRNA)成为调节HSCs分化的重要因子。 实际上,在几种血细胞中发现了circRNA的表达,而且circRNA存在神经元和心肌分化细胞、胞外囊泡中,这些发现促使作者探究circRNAs是否在造血细胞中表达,circRNA的表达是否会在造血分化过程中发生改变。

来自阿姆斯特丹大学的Wolkers MC教授团队最近在Nucleic Acids Research(IF=11.561)杂志在线发表了题为“Circular RNA expression in human hematopoietic cells is widespread and cell-type specific”的基于circRNA生物信息学的研究,首次报道了circRNA在人造血祖细胞和其分化后的淋系与髓系细胞中的表达模式和特性,揭示了circRNA在这些细胞中的表达广泛性和特异性,并在成熟过程中表达水平上调,circRNA剪接变异体表达也是细胞特异性,而且有核造血细胞含有CLR(circRNA/mRNA)>1的circRNA,另外血小板和红细胞中的circRNA的含量最高,在成熟过程中circRNA的类型和数量会发生改变,这提示了circRNA细胞类型特异性表达模式在造血细胞的分化和细胞功能中发挥未知的作用。
CircRNAs具有独特的索尾剪接方式,这促使我们可以很容易从RNA-seq数据中比对出嵌合读长,并可以从线性RNA中区分出circRNAs。作者从NCBI中获取已经报道过的人原代造血细胞的转录组深度测序数据,从中分析其分化过程中circRNAs的表达模式。所以作者挖掘了超过59000种circRNAs,其中超过14000种circRNAs被新发现并注释。
文章中筛选数据库用到的标准和数据库的分析方法: 去除核糖体RNA后的总RNA的测序数据用于粒细胞、红细胞和血小板分化时circRNAs的表达模式分析,而其他造血细胞中的circRNAs的表达模式分析使用的是总RNA测序数据。作者使用STAR version 2.5.2b去挖掘嵌合体读长,即circRNAs,再利用DCC 0.4.4和CircExplorer2 (CE)去检测、过滤和注释circRNAs。circRNA表达模式被认为是低可信度检测,指的是通过DCC和CE分析方法在至少一个样本中发现2个剪接读长;而circRNA表达模式被认为是高可信度检测,指的是通过DCC和CE分析方法在一个特异细胞类型的所有生物复制本中发现至少2个剪接读长。DESeq2用于分析高可信度circRNA的差异表达分析。CLR 是指circular circRNA RPM与linear circRNA RPM的比值。
推荐理由:这篇研究基于现有的数据库,通过一定的分析工具(DCC和CE)获取不同造血细胞中circRNA和mRNA的表达情况,选择合适、使用合适的分析方法对于数据分析很重要,而且本文巧妙利用circRNA/gene、exons/circRNA、CLR等分析指标可以直观、客观得反映出细胞circRNA表达模式的情况,让我们对造血细胞中circRNA的表达模式有了全面和新的认识,这也是这篇文章能发在这么高分杂志的原因之一。
1. 通过RNA-seq数据分析circRNAs在造血细胞中的表达情况: 作者利用DCC和CE工具对造血细胞的总RNA测序数据分析,DCC发现了13898种circRNAs,而CE分析发现了5072种circRNAs,为了减少假阳性,选取了两者共同的4103种circRNAs,其中1003种circRNAs还没被circBase数据库收录注释,996种circRNAs没被CircNet数据库收录注释,428种circRNAs没被两个数据库收录注释(C-D)。体外设计引物在人外周血单核细胞中对新发现的circRNAs进行RT-PCR验证,在挑选的39种circRNAs中有13种是属于新发现的(E)。而且这些circRNAs是耐受RNAse R酶的消化(F)。
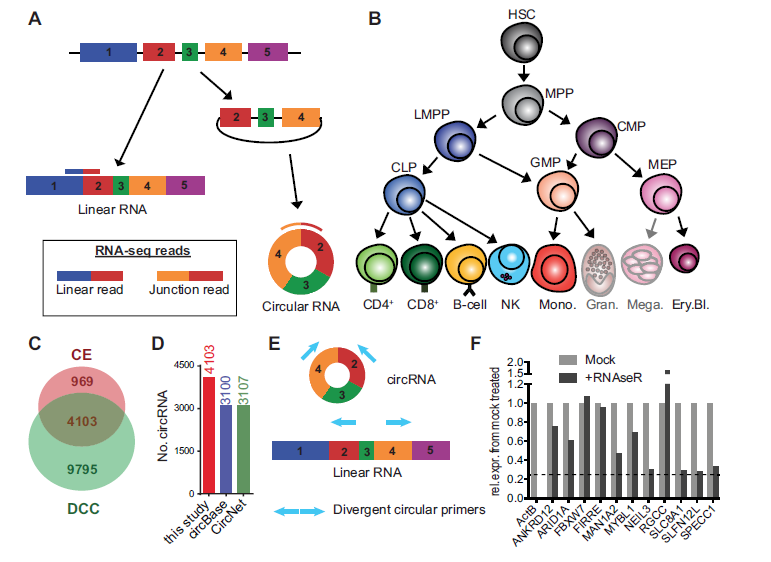
2. 造血细胞中circRNA的形成、长度大小和分布情况
对每条染色体上形成的circRNAs数目进行了分析(A);以上的4103种circRNAs所含的外显子数目平均为5.96个,最小值和最大值分别为1个和56个,其长度大小平均为1057nt(B-C)。为明确一个基因可以形成多少个circRNAs变异体,即circRNA对于不同基因的利用率,作者发现一个基因平均可以生成2.3种circRNAs,最小值和最大值分别为1种和26种。每个基因可以形成的circRNA变异体数目与每个circRNA转录本包含的外显子数目没有明显关联,说明circRNA的形成不是个随机事件(D-E)。接着,作者为明确哪个外显子可作为起始外显子用于环化反应和哪个外显子用于尾部剪接反应,发现circRNAs环化不会倾向选择第一个和最后一个外显子启动环化,起始一般会选择基因的第二个外显子(29.2%),但是环化末端的外显子并没有特别倾向第几个外显子(F-G)。
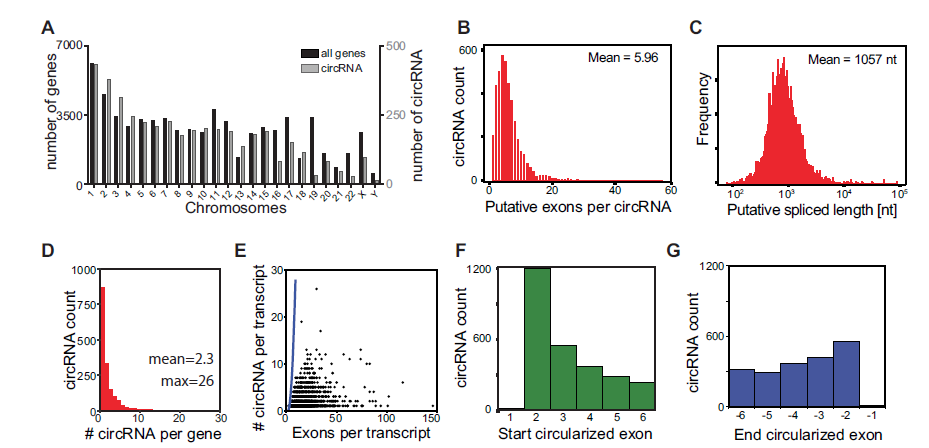
3. circRNA的表达模式在造血细胞分化过程中发生变化
本文的重要在于探究在造血细胞分化过程中circRNA的表达会发生什么变化。根据之前所说的高可信度标准分析,通过DCC和CE工具共同分析可获得489 种交叉的高可信度circRNAs(A)。接着通过主成分分析PCA分析造血细胞分化过程中circRNA的表达,发现对角线上分布的点是造血干细胞和祖细胞,淋系细胞分布的点位于左上角,而髓系细胞分布的点位于右下角,说明分化的髓系细胞circRNA表达模式从祖细胞表达模式中分离,朝着与分化成熟的淋系细胞表达模式相反的方向发展(B)。基于circRNA表达模式的聚类分析也发现造血干细胞和祖细胞circRNA表达不同于分化后的髓系细胞和淋系细胞的circRNA表达(C)。淋巴细胞含有最高数目的circRNAs,但是不同细胞亚群中含有其特有circRNAs数目是没有明显差异,说明淋巴细胞circRNA总数多不是因为circRNA的多样性多,而是circRNA表达丰度高(D-E)。
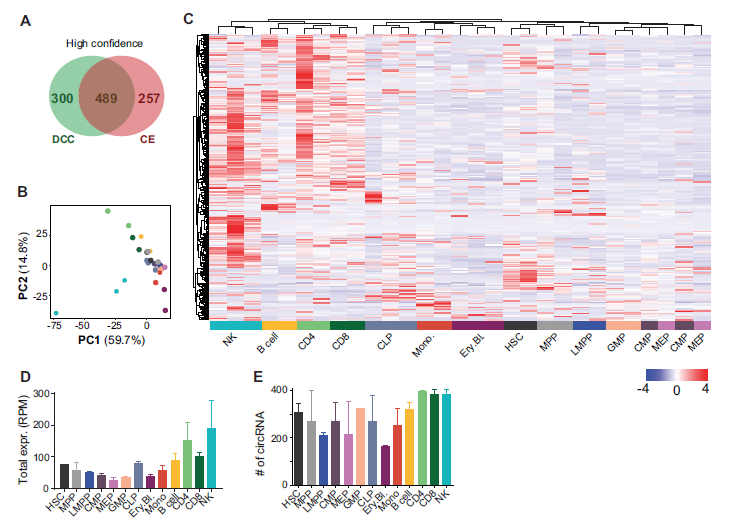
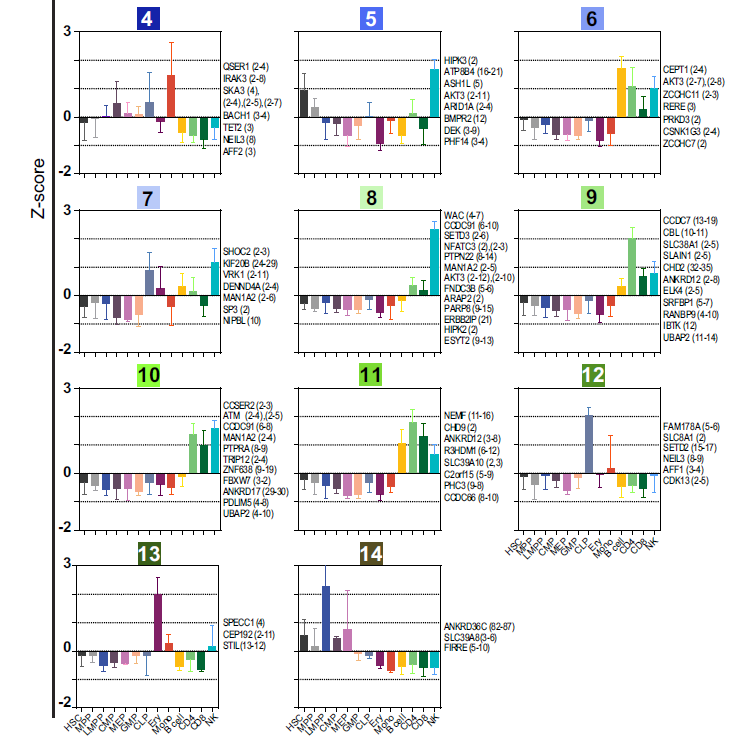
4. 在造血细胞分化过程中circRNA的表达模式是细胞类型特异的
通过DESeq2分析,作者明确了102种差异表达的circRNAs(A);2,3,5,12,14簇说明了祖细胞特异表达的circRNAs,1, 6, 7,8, 9, 10 和11簇说明了淋系细胞特异表达的circRNAs;4,13簇说明了髓系细胞特异表达的circRNAs,当然可以具体到哪些细胞高表达哪些特异的circRNA,同时这些图还反映了利用同一基因的不同外显子形成的circRNA在不同细胞亚群中表达水平也不一样,说明对于不同分化阶段的细胞需要同一个基因形成的不同circRNA来发挥某些功能,进一步证明circRNA表达是细胞类型特异的(B)。
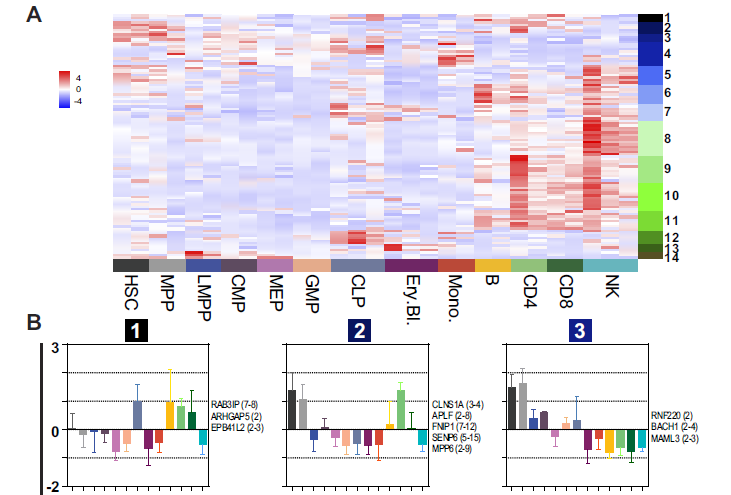
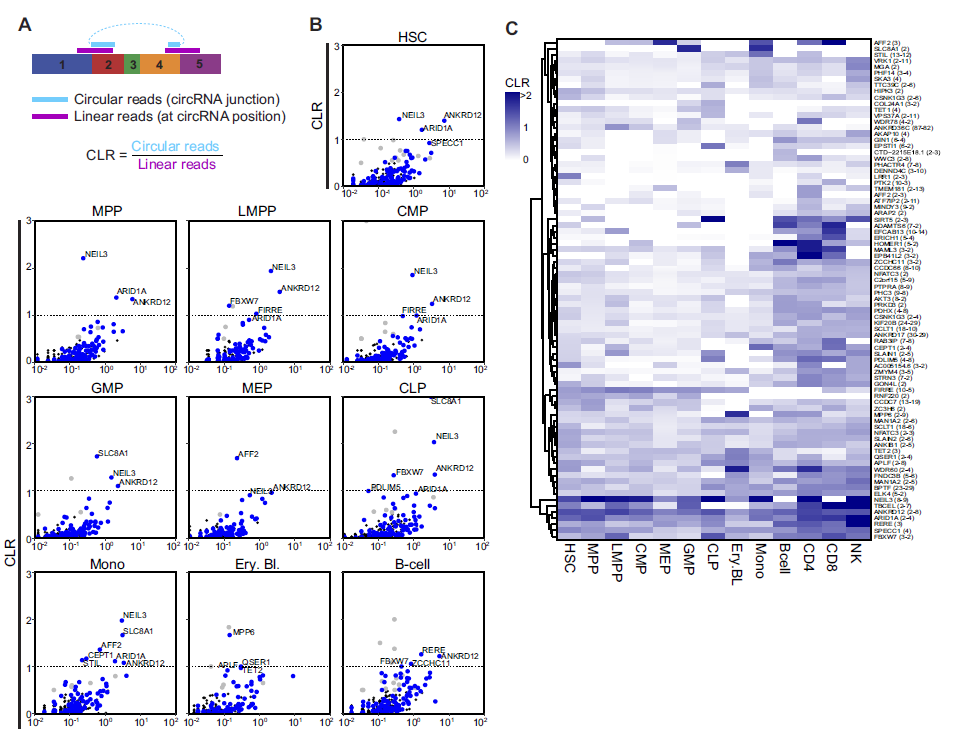
5. 在造血细胞分化过程中circRNA/mRNA比值(CLR)会发生变化
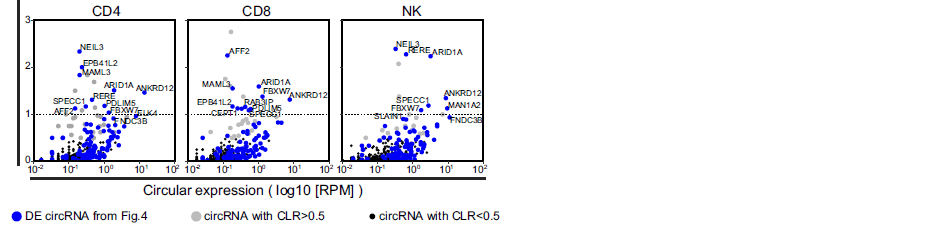
对figure 3中489种高可信度circRNAs分析其在造血细胞亚群中的CLR,发现有82种circRNAs的CLR 大于0.5(说明circRNA表达水平至少达到mRNA表达水平的50%),还有一些circRNAs的CLR 大于1,而同时figure 4中102种差异表达的circRNA的CLR表达模式也在这里得到了验证(A-B)。
接下来,作者对CLR 大于0.5的circRNAs在各个细胞亚群进行了热图分析,说明了这些circRNAs表达水平在祖细胞和其分化后细胞中的表达水平不同,是具有细胞类型特异性的,并随着祖细胞分化而发生明显的改变(C)。
6. 红细胞和血小板表达更高水平的circRNAs
为分析粒细胞、红细胞和血小板中circRNA表达水平,采用了已报道的对于这些细胞的测序数据,分析了59 011种 circRNAs,只有28 841和 42 082 种circRNAs分别被 circBase 和CircNet,超过14 100 种circRNA (23.9%)属于新发现的(A)。通过高可信度阈值分析,虽然获得的circRNAs总数减少了,但是血小板和红细胞中circRNA数目还是位于第一和第二(B-C)。在三种细胞中每个基因形成的circRNA变异体(circRNA/gene)和exons/circRNA的分布情况,发现还是血小板和红细胞的两个指标的平均值位于第一和第二位(D),而且与其他造血细胞(祖细胞、淋系细胞和髓细胞)相比,无核细胞(血小板和红细胞)中circRNA的相对表达水平和circRNA/gene的数目都是非常高的。同时作者还发现粒细胞、血小板和红细胞中CLR >0.5 或者CLR >1的circRNA数目都是普遍偏多的,说明这些细胞中circRNA表达高,并且表达高的circRNA数目都要远高于其他祖细胞和分化细胞的,而且要高于自身祖细胞的(E-F)。
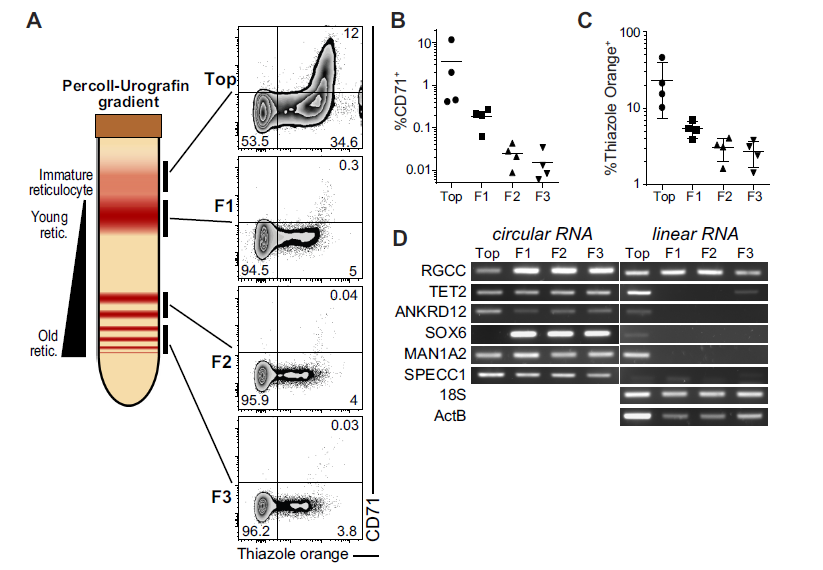
7.衰老的红细胞依然稳定表达circRNA
红细胞在体内的寿命周期约为120天,期间会逐渐衰老。作者通过Percoll-Urografin梯度分离出处于不同阶段的红细胞,然后通过流式检测红细胞衰老的相应marker,红细胞衰老时CD71分子丢失,胞核的TO染色也逐渐降低(A-C)。RT-PCR检测红细胞特异性高表达和CLR大于0.5的circRNAs和mRNAs,衰老时β−ACTIN mRNA, 18S RNA, and RGCC mRNA依然稳定表达,而其他mRNAs表达随分化成熟而丢失;相反circ-TET2 (exon 3), circ-ANKRD12 (exon 2–8), circ-MAN1A2(exon 2–5) 和 SPECC1(exon 4)依然稳定表达。
参考文献
1. Nicolet BP, et al. Circular RNA expression in human hematopoietic cells is widespread and cell-type specific. Nucleic Acids Res. 2018 Aug 14. doi: 10.1093/nar/gky721.
.png)