近年来,环状RNA(circRNAs)被认为是重要的表观遗传调控因子,参与各种肿瘤生物学过程,其前世今生、生物学功能以及研究现状可参考以往解读。
相关阅读:环状RNA从无名之辈成为“顶流”?深度解读环状RNA的前世今生与未来
2023年11月16日,浙江大学张红河教授团队在Cell Death and Disease(IF=9.0)发表文章”Specific intracellular retention of circSKA3 promotes colorectal cancer metastasis by attenuating ubiquitination and degradation of SLUG”。
在本研究中,circSKA3在CRC组织中表达上调,而在血清样本中表达下调,在体外和体内都促进了CRC的进展,并通过特定的细胞motif元件保留在CRC细胞中,而非外泌体。circSKA3上的细胞motif元件也是circSKA3与SLUG相互作用的位点,它抑制SLUG泛素化降解,促进CRC上皮-间充质转化(EMT)。此外,FUS能够与circSKA3的特定motif结合,被确定为是调控circSKA3环化的关键因子。而靶向环化和细胞motif元件的特异性反义寡核苷酸(ASOs),可抑制circSKA3的表达,消除SLUG-circSKA3的相互作用,抑制CRC EMT和转移。

circSKA3在CRC组织中表达升高,而在血清外泌体中表达降低
首先,作者对10例CRC患者的正常黏膜样本、腺瘤和腺癌组织样本进行环状RNA测序,与正常组织相比,腺瘤样本中191个环状RNA上调,腺癌样本中277个环状RNA上调。随后将得到的数据与GSE100206和GSE100063 GEO数据(这些数据集包括来自32名健康供体和12名CRC患者的血清外泌体circRNA测序数据)交叉分析显示,只有hsa_circ_0000467是共有的基因(图1A-B)。但是,hsa_circ_0000467在结直肠腺瘤和腺癌组织中的表达显著增加,在CRC患者血清外泌体中下降。
hsa_circ_0000467宿主基因是SKA3,下文将其称为circSKA3。背靠背引物设计/RNase R和放线菌素D分别验证circSKA3的环状结构和耐受消化(图1D-F)。circSKA3在结直肠腺瘤和腺癌组织中的表达显著增加已有证明(图1G)。Kaplan-Meier(K-M)生存分析显示,高水平的circSKA3与CRC患者的不良预后显著相关(图1H)。但与正常对照组相比,CRC患者血清中circSKA3水平明显降低(图1I)。综上所述,circSKA3可能在结直肠癌中发挥致癌作用,但是在组织和血清外泌体中的表达不同。
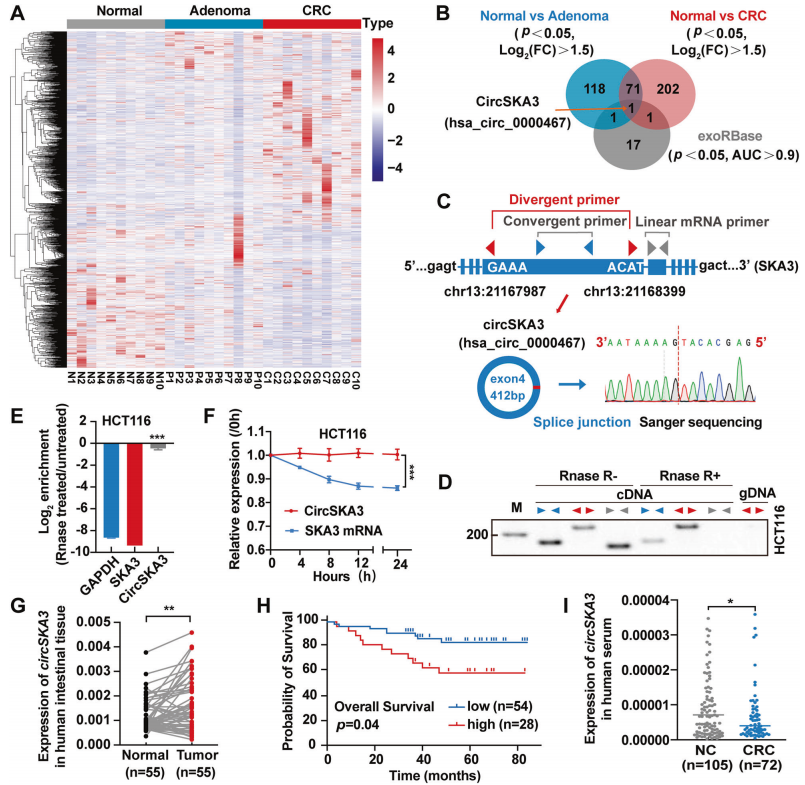
图1 CircSKA3在CRC中的特征及表达
CircSKA3促进CRC细胞的迁移、侵袭和转移
为了阐明circSKA3在结直肠癌中的生物学作用,作者检测了circSKA3在结直肠癌细胞系中的表达。CRC细胞系(HCT116、SW620、SW480和HCT8)中circSKA3水平高于其他类型的细胞,包括NCM460、Helf和Caf(图2A)。因此,HCT116和SW620细胞被选做后续的研究中。作者采用靶向BSJ位点的siRNA+shRNA+慢病毒循序渐进地构建circSKA3敲低稳转株(图2B-D)。结果显示,敲低circSKA3抑制了癌细胞迁移和侵袭,但仅轻度抑制细胞增殖(图2E)。为了进一步证实circSKA3在结直肠癌中的致癌作用,作者使用了CRISPR-RfxCas13d/BSJ-gRNA敲除circSKA3,该gRNA特异性靶向HCT116和SW620细胞中的circSKA3 BSJ位点(图2F)。同敲低稳转株一样,敲除circSKA3,癌细胞迁移和侵袭明显受到抑制,不过细胞增殖没有明显变化(图2H-J)。另外,作者过表达circSKA3显著促进了癌细胞迁移和侵袭,但不影响细胞增殖。过表达circSKA3能够逆转敲低HCT116细胞中的迁移和侵袭状态。过表达和敲低技术均不影响母基因mRNA和蛋白表达。综上,circSKA3在体外可促进CRC细胞的迁移和侵袭。
为了进一步评价circSKA3对体内结直肠癌进展的生物学作用,作者敲低circSKA3的稳转HCT116细胞注入BALB/c裸鼠脾脏,构建肝转移模型。与体外实验结果一致,肝转移灶和肿瘤面积明显低于对照组。下调circSKA3显著改善了预后。综上所述,这些结果阐明了circSKA3在CRC的进展发挥致癌作用,而非其宿主基因SKA3的作用。
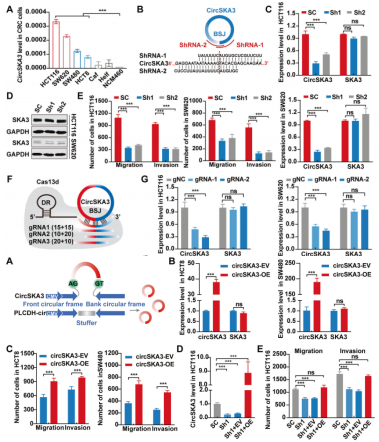
图2 circSKA3促进CRC细胞的迁移、侵袭和转移
circSKA3因含独特motif,保留在CRC细胞质而非外泌体中
已经证明circSKA3在结直肠癌组织中表达上调,而在血清外泌体中表达下调。此外,已知circSKA3在结直肠癌中发挥致癌作用。之前的研究表明,CRC细胞在外泌体中积极产生肿瘤抑制环状RNA[5]。然而,目前尚不清楚CRC细胞是否会优先保留致癌环状RNA来维持其恶性行为。为了找到答案,作者首先使用核质分离试剂盒来确认circSKA3主要位于细胞质中(图3A)。接下来,我们通过超离心法在不同的细胞系中分离出外泌体,电镜和WB鉴定外泌体(图3B-C)。在CRC细胞系中,过表达的circSKA3仍优先保留在细胞质中,而在正常细胞系中,它优先在外泌体中(图3D)。
miRNA中特殊的外泌体motif和细胞motif在不同类型的组织中可决定基因是在细胞内保留还是会随外泌体分泌。随后作者想确定circSKA3中是否有特殊motif来调控其在CRC细胞中的保留。因此,作者构建了4个被截断的circSKA3表达载体,详见(图3E)。核苷酸缺失276-378nt(Δ4)的circSKA3水平在细胞质中较低,但在外泌体中高于其他被截断的circSKA3(Δ1、Δ2和Δ3)水平(图3F),提示Δ4的独特之处。为了进一步鉴定circSKA3中的细胞motif,我们构建了另外两个circSKA3表达载体,分别缺失核苷酸276-312(Δ4-1)和核苷酸313-378(Δ4-2)。与Δ4-1载体相比,缺失核苷酸313-378nt的载体(Δ4-2)显著减少了circSKA3的细胞内保留(图3G),再度缩小了Δ4的范围。作者发现了circSKA3-Δ4上有个细胞motif(AGAAC),它可以调节circSKA3停留在细胞内(图3H)。而删除该细胞motif,可降低了circSKA3在细胞内的停留,增加circSKA3的外泌体分泌(图3I)。综上表示,circSKA3是因为含有独特的细胞motif才导致其主要被保留在细胞质中。
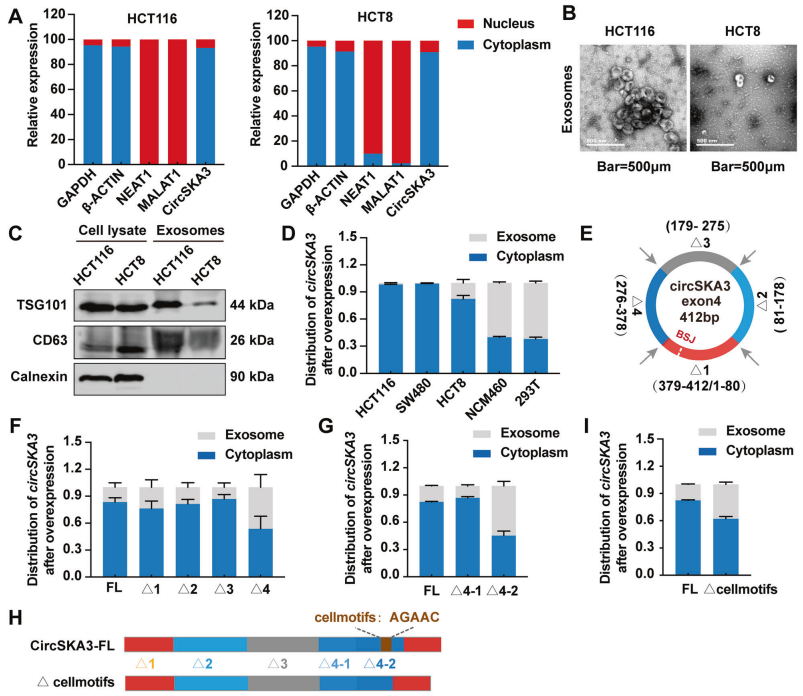
图3 circSKA3保留在CRC细胞的细胞质而非外泌体中
circSKA3通过与结直肠癌中的SLUG相互作用,促进上皮-间充质转化(EMT)
为了阐明circSKA3促进结直肠癌进展的具体机制,作者对稳定circSKA3敲低的HCT116细胞进行了mRNA测序。最终差异表达的基因富集到EMT信号通路(图4A)。GSEA结果显示,circSKA3基因敲低也与EMT通路显著相关(图4B)。circSKA3的下调可降低间充质相关标志物如波形蛋白和SLUG的表达,而增加了上皮相关标志物如E-CADHRIN和ZO1的表达;过表达circSKA3则相反(图4C)。这些数据进一步证明了circSKA3促进CRC细胞的EMT。
环状RNA通过编码短肽发挥作用已有报道。为了验证circSKA3是否通过类似的机制促进结直肠癌中的EMT,作者使用TransCirc网站分析了circSKA3序列,又将FLAG序列克隆到circSKA3过表达载体中验证翻译,但是发现没有翻译效应。这表明,circSKA3不通过编码蛋白在CRC中发挥作用。
作者为了进一步阐明circSKA3在结直肠癌进展中的分子机制,运用pulldown和RIP实验技术验证了circSKA3结合SLUG(图4E)。此外,作者运用截断的circSKA3载体转染到HCT8细胞中,以识别circSKA3中通过与SLUG结合促进肿瘤的motif。第一个结果表明,1-1和4-2基序可能是circSKA3的关键调控域,在促进CRC转移中发挥作用。第二个结果表明,4-2基序缺失可消除SLUG与circSKA3的结合,提示细胞motif不仅介导了circSKA3保留在细胞中,还影响着SLUG与circSKA3的互作。
然而,circSKA3如何在结直肠癌进展中调节SLUG尚不清楚。作者敲低circSKA3可抑制SLUG的蛋白表达,推测circSKA3与SLUG的相互作用可能会稳定SLUG的蛋白水平。因此,我们使用环己酰亚胺(CHX)跟踪分析来分析SLUG的稳定性,结果显示,在circSKA3敲低的CRC细胞中,SLUG的半衰期显著降低(图4I)。蛋白酶体抑制剂MG132逆转了circSKA3敲低导致的SLUG蛋白水平的下降(图4J)。为了检测circSKA3是否通过调节泛素化促进SLUG蛋白的稳定性,我们将HA-Ub、FLAGSLUG和circSKA3表达载体共转染到293 T细胞中,然后用MG132处理细胞6h。IP检测结果显示,过表达circSKA3显著抑制了SLUG的泛素化降解(图4K)。这些数据表明,circSKA3可以通过阻断泛素化来稳定SLUG。
接下来,作者使用IHC检测小鼠CRC脾肝转移模型原位病变切片中波形蛋白、e-钙粘蛋白和SLUG的表达,结果显示敲低circSKA3提升e-钙粘蛋白水平,降低波形蛋白和SLUG水平(图4L)。最后,采用qPCR检测85例CRC样本中的波形蛋白水平。结果显示,circSKA3水平与波形蛋白的表达呈正相关(图4M)。
综上所述,circSKA3通过抑制SLUG泛素化降解,促进结直肠癌的EMT和转移。
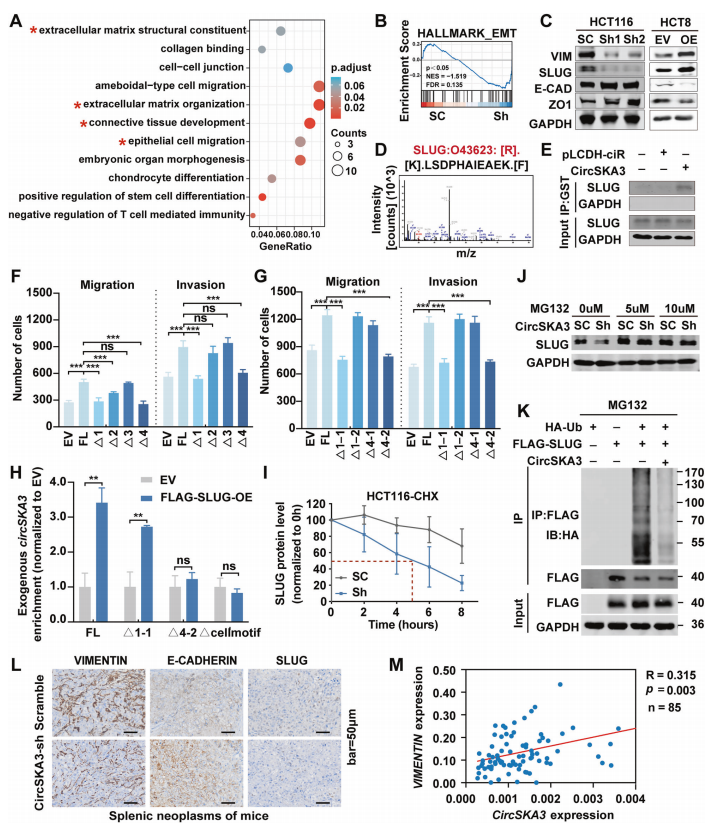
图4 circSKA3通过稳定SLUG来促进CRC中的EMT
FUS通过与特定motif结合来调节circSKA3的环化
circRNA的反剪接不仅受到两侧内含子的互补元件的调控,还受到外显子中的self-motif的调控。为了鉴定调控circSKA3环化的self-motif,作者将上述circSKA3的截断载体转染到CRC细胞中,然后检测circSKA3环化的效率(图5A)。结果发现,circSKA3-Δ1和Δ2能够降低circSKA3的环化效率,而Δ4能够增加环化效率(图5B)。此外,这些截断均未影响宿主基因SKA3的表达(图5B)。
作者进一步构建Δ1-1/Δ1-2/Δ2-1/Δ2-2载体,发现Δ1-2和Δ2-1处理细胞,circSKA3的环化效率显著降低。不过,运用之前Δ4-2载体同样操作发现,能够增加环化。所有截断载体均未改变SKA3 mRNA水平(图5C)。这些结果表明,1-1、1-2和2-1片段是其外显子中正向调控circSKA3循环化的顺式元件,而4-2片段是负调控元件。
为了进一步说明circSKA3的环化机制,作者通过circAtlas网站(http://circatlas.biols.ac.cn/)预测了与circSKA3结合的RBP。质谱数据显示,多功能DNA/RNA结合蛋白FUS是circSKA3的一个RBP(图5D)。然后,通过GST-RNA pulldown和RIP实验证实了circSKA3与FUS相互作用,而非母基因(图5E-G)。此外,FUS敲低抑制了circSKA3的表达,而没有抑制SKA3的表达(图5H)。进一步发现,FUS可以与FL、Δ1-2和Δ2-1 circSKA3结合,而不能与Δ1-1 circSKA3结合,这表明FUS通过与1-1的motif相互作用,正向调控circSKA3的环化(图5I-J)。此外,作者也检测了85个CRC样本中circSKA3和FUS的mRNA水平,发现circSKA3与FUS呈显著正相关(图5K)。
综上所述,这些数据表明,FUS可通过与circSKA3的1-1基序结合,作为正调控元件结合,促进了circSKA3的环化。
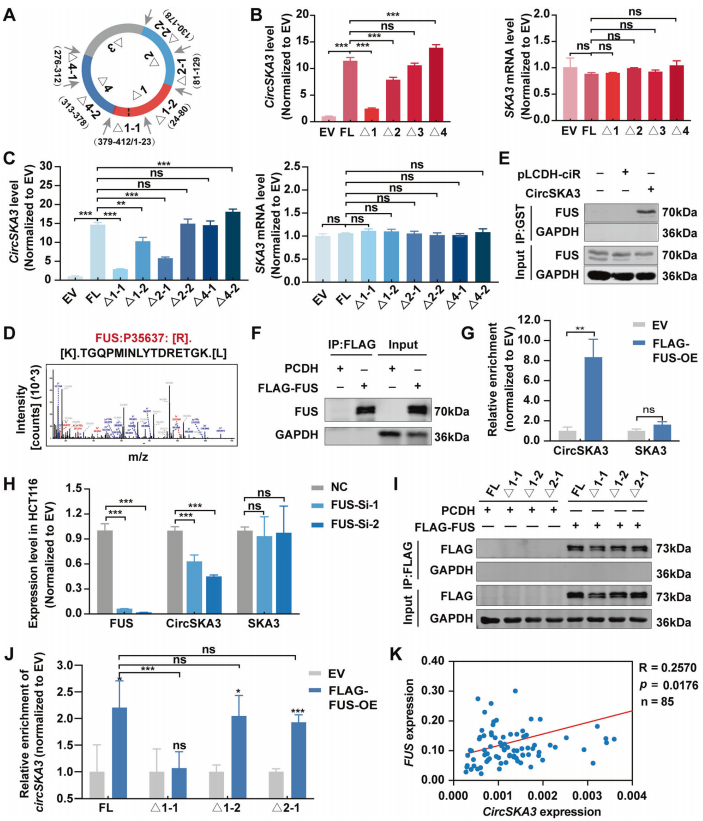
图5 FUS通过与特定motif结合来调节circSKA3的环化
ASOs靶向成环元件和细胞motif抑制结直肠癌转移
前面结果讲到剪接因子FUS通过与特定的调控元件结合来促进circSKA3的环状化,因此推测阻断FUS与circSKA3之间的相互作用可能会抑制CRC的转移。这提示,在circSKA3中,消除SLUG与细胞motif的结合可能是通过circSKA3途径靶向抑制结直肠癌转移的一种替代疗法。
作者设计了针对环状调节元件(ASO1-1-1和ASO1-1-2)和细胞motif(ASO4-2-1和ASO4-2-2)(图6A)。结果显示,只有ASO1-1-1显著抑制了circSKA3的表达,而其他ASOs对circSKA3的表达无调控作用;当然,这些ASOs均不影响母基因的表达(图6B)。细胞功能实验显示,ASO1-1-1和ASO4-2-1都能显著抑制CRC细胞的迁移和侵袭(图6C-D)。这些结果表明,ASO1-1-1抑制了circSKA3的环化发挥抑癌作用;ASO4-2-1阻止了circSKA3与SLUG的相互作用发挥抑癌作用。
为了检验ASOs在体内的治疗效果,作者通过脾脏注射HCT116细胞构建了小鼠肝转移模型(图6E)。通过6个周期的ASOs注射(2天注射一次),ASOs小鼠相比对照组体重上无显著性差异(图6G),这可能是由荷瘤小鼠的恶病质引起的原因。
不过,ASO1-1-1和ASO4-2-1治疗组的肝转移瘤数量明显减少,脾脏原位肿瘤浸润边缘较小,肝脏转移灶较小。联合ASO组没有明显的肝转移(图6H-J)。IHC结果显示,各ASO均抑制了波形蛋白和SLUG的表达,增强了e-钙粘蛋白的表达,ASOs联合处理对e-钙粘蛋白、波形蛋白和SLUG也有显著影响(图6K-L)。体内数据进一步支持了特异性ASOs可以通过抑制circSKA3环化或circSKA3-SLUG相互作用来抑制CRC进展。
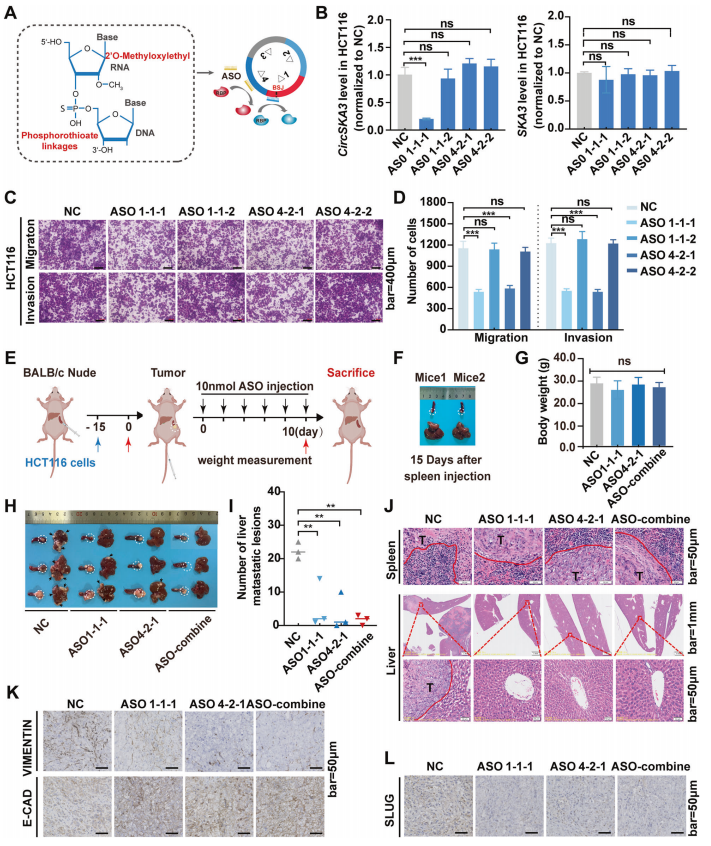
图6 ASOs靶向成环元件和细胞motif抑制结直肠癌转移
总结
CRC细胞可能通过特定的细胞motif将circSKA3保留在细胞质中,抑制外泌体分泌;细胞内circSKA3可以阻断SLUG泛素化降解,从而促进CRC转移。针对circSKA3的关键环化元件和功能motif的特异性ASOs可能成为潜在的CRC治疗药物。
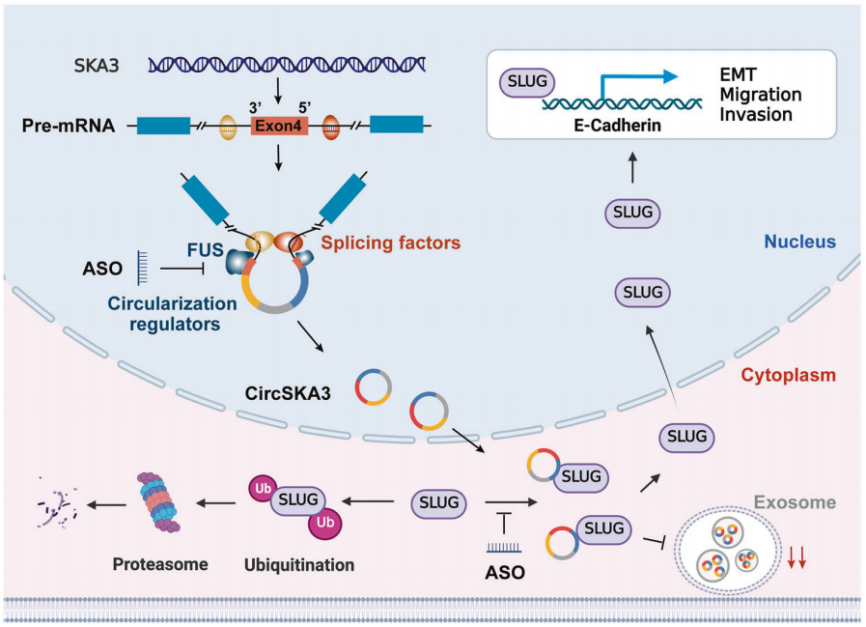
图7 circSKA3通过减弱SLUG的泛素化降解来促进结直肠癌的进展
原文链接
https://doi.org/10.1038/s41419-023-06279-w
.png)