前不久我们介绍过新加坡A*STAR及国立大学陈小元/东南大学及南京医科大学夏洪平/皖南医学院江晓春团队运用环状RNA体外制备和LNP包封等新一代技术融合,为研究mRNA靶向治疗癌症提供了有力的参考。
详情见:Nat Cancer丨体外转录的环状RNA可靶向线粒体内膜心磷脂来抑制EIF4G2+/PTBP1+泛腺癌生成
紧接着,在2023年10月28日,四川大学华西医院彭勇教授在Nature Communications(IF=16.6)发表文章“A circular RNA activated by TGFβ promotes tumor metastasis through enhancing IGF2BP3-mediated PDPN mRNA stability”。彭勇教授团队发现一种转化生长因子(TGFβ)调控的环状RNA——circITGB6,其本身可调控TGFβ介导的上皮-间充质转化(EMT)过程,影响癌细胞转移。其具体机制在于,circITGB6可与IGF2BP3互作,增强emt促进波多普兰素(PDPN)的mRNA稳定性,从而促进肿瘤转移;而用pei包被的circITGB6-siRNA可有效抑制癌细胞转移。研究揭示了TGFβ调控的circRNA本身在肿瘤转移中的功能,并提示靶向circITGB6是一种很有前途的癌症治疗策略。

circITGB6在TGFβ诱导的EMT过程中显著上调,并与CRC患者预后较差密切相关
转录组对TGFβ处理和未处理的MCF10A细胞样本进行测序发现,circITGB6(hsa_circ_0056856)在TGFβ处理组中表达量最高,后续也在细胞水平上有进一步验证,并呈现剂量依赖性(图1a-d)。这提示TGFβ可诱导circITGB6表达。
随后作者验证了circITGB6的特性——成环/耐受切割/定位胞核和胞质(图1e-j)。有报道讲,QKI介导的反向剪接参与了TGFβ诱导的EMT过程[1]。环状RNA也是经过反向剪切产生的。作者想看一看circITGB6表达是否和QKI有关。不过实验结果表示,QKI几乎不影响circITGB6的丰度,表明可能是其他机制导致TGFβ刺激下circITGB6的上调,而非QKI。
宿主基因转录水平的增加也可能上调circRNA的表达。经过验证,过表达TGFβ上调circITGB6的同时,也增加了ITGB6的表达,提示circITGB6的增加可能与其宿主基因的转录有关。不过定量数据表明,circITGB6是TGFβ诱导的主要产物,而非宿主转录本。
作者比对人类和小鼠circITGB6的序列同源性为84.24%,表明circITGB6在人和小鼠之间高度保守。实验表示,小鼠circITGB6也是可以被TGFβ诱导表达的。不过,有趣的是,circITGB6在正常小鼠乳腺组织中未检测到,但在癌变组织中高表达,这意味着circITGB6在肿瘤发生过程中具有致癌作用。
TGFβ在肿瘤转移中起着关键作用。为此,作者用80个CRC样本来检测circITGB6相关度。在高期(III期)、大尺寸肿瘤(≥5cm)和伴有淋巴结转移的结直肠癌中,circITGB6的表达显著增加;且CRC患者较差的预后,显示出较高的circITGB6水平。因此,circITGB6的表达可能是CRC患者癌细胞转移和较差预后的潜在预测因子。
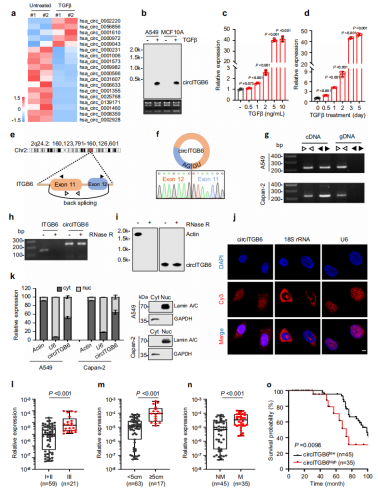 图1 circITGB6在TGFβ诱导表达并与CRC患者预后较差密切相关
图1 circITGB6在TGFβ诱导表达并与CRC患者预后较差密切相关
circITGB6诱导EMT过程,促进肿瘤转移
确定完circITGB6的特征及其与肿瘤转移的相关性后,作者在体外和体内模型中加强研究其生物学功能,circITGB6-OE和-KD细胞系被引入研究中。亚细胞定位显示外源表达的circITGB6具有与内源性相同的定位,并且,circITGB6-OE和KD均不影响宿主基因ITGB6表达,可排除circITGB6通过ITGB6通路发挥其生物学功能。
circITGB6-OE显著促进了癌细胞迁移,而circITGB6-KD可逆转这一效应(图2b-c)。此外,circITGB6-OE降低癌细胞上皮标志物E-cadherin水平,而提高N-cadherin和vimentin水平,而circITGB6-KD可逆转这一效应,这提示circITGB6是正向调控癌细胞转移(图2d-e)。
为了证实TGFβ信号激活对circITGB6的依赖性,作者使用两种独立的circITGB6敲低载体——shRNA1/2。结果显示,TGFβ处理下,circITGB6的shRNA下调自身表达(图2f);并且circITGB6下调显著阻断了TGFβ刺激引发的EMT过程(上皮标志物E-cadherin水平降低,而N-cadherin和vimentin上调)(图2g)。与此一致,下调circITGB6对EMT过程(TGFβ诱导的细胞迁移和癌转移有拮抗作用)(图2h-i)。初步提示,circITGB6可作为癌转移的生物标志物和靶向治疗标志物。
上述验证均在体外细胞水平完成,接下来作者通过注射SW620稳转株细胞(circITGB6过表达和对照)建立了免疫缺陷肝转移裸鼠模型。与对照组细胞相比,过表达circITGB6的SW620细胞更容易在小鼠肝脏中形成转移性病变(图2j-k)。为了进一步证实这些发现,作者又开发了基于心内注射的全身转移模型来模拟癌症进展的临床参数。circITGB6基因敲低显著减少了脑和骨转移性病变的数量和大小(图2l-m)。这再度提示,circITGB6在体内能正向调控肿瘤转移。
 图2 circITGB6促进EMT过程和肿瘤转移
图2 circITGB6促进EMT过程和肿瘤转移
circITGB6,而不是其线性转录本,发挥了促进转移的作用
考虑到环状RNA过表达质粒产生大量的线性转录本,这些转录本可能没有完全转化为环状RNA。为了排除这种可能性,作者将circITGB6-OE质粒从AG突变为TT,生成不能成环的(CD)突变体(图3a-b)。与野生型相比,circITGB6-CD对EMT过程和细胞迁移没有明显影响;体外小鼠模型实验进一步证实了上述结果(图3c-f)。综上所述,circITGB6诱导了EMT过程和肿瘤转移,而不依赖于其线性转录本。
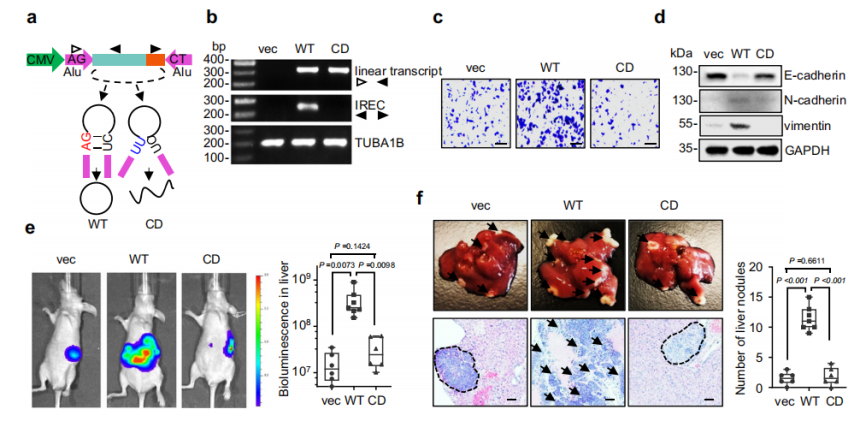 图3 circITGB6的转移作用独立于线性转录本
图3 circITGB6的转移作用独立于线性转录本
circITGB6与IGF2BP3相互作用,促进肿瘤转移
越来越多的证据表明,环状RNA通过不同的机制参与不同的生物过程,如miRNA海绵,蛋白质相互作用或翻译为功能肽。数据库分析显示,circITGB6没有IRES元件,翻译能力有限并且自身没有多少潜在结合miRNA的位点,所以circITGB6应该只可能发挥了蛋白互作。
为了鉴定circITGB6相互作用的蛋白,作者采用pulldown技术(探针法)钓取蛋白,然后跑考马斯发现70kDa(红色箭头)位置有一条蛋白条带突出,切胶质谱发现,胰岛素样生长因子2 mRNA结合蛋白3(IGF2BP3)在circITGB6潜在相互作用蛋白中得分最高(图4a-b)。随后作者又多方面印证circITGB6结合IGF2BP3(图4e)。此外,在TGFβ刺激下,由于circITGB6丰度的增加,IGF2BP3和circITGB6互作也增强(图4f)。免疫荧光和荧光原位杂交(IF/FISH)显示,circITGB6和IGF2BP3共定位,且不受circITGB6敲除或TGFβ应激的影响。因此,提示circITGB6和IGF2BP3之间的相互作用没有细胞类型/组织特异性。
为了探讨IGF2BP3是否有助于circITGB6的促进转移的作用,作者建立了两个靶向IGF2BP3的shRNA,并转染到circITGB6-OE稳定细胞中。结果显示,敲除IGF2BP3可减弱circITGB6对EMT表达的影响(图4g-h)。综上所述,IGF2BP3可能是circITGB6发挥功能的关键影响因子。
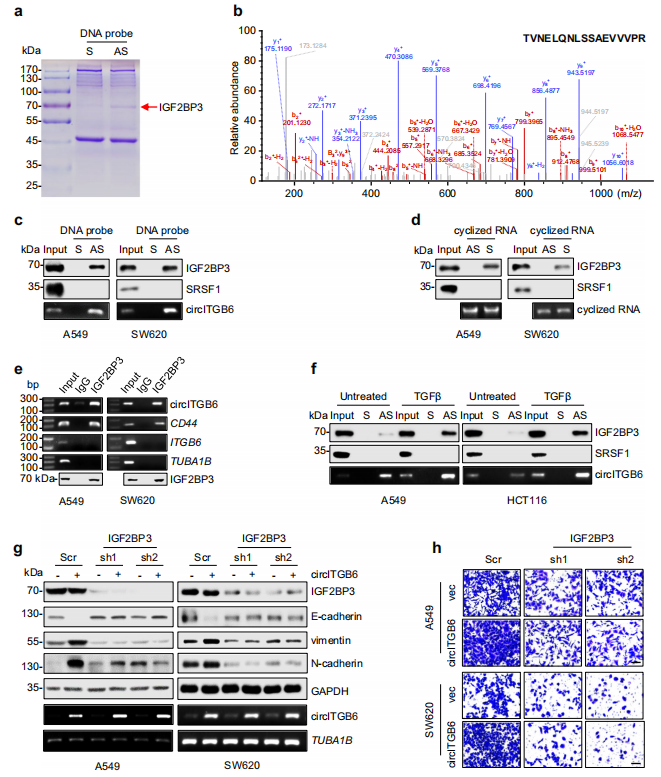 图4 circITGB6与IGF2BP3相互作用,促进肿瘤转移
图4 circITGB6与IGF2BP3相互作用,促进肿瘤转移
circITGB6中的“CAUU”区域对于其与IGF2BP3的直接相互作用至关重要
IGF2BP3优先结合于“CAUH(H=A,U或C)”的共识元件。为了阐明circITGB6和IGF2BP3之间关联的分子基础,利用RBPmap数据库,作者预测了circITGB6中两个潜在的IGF2BP3结合区域(包含“CAUU”或“CAUCA”),并生成了两个生物素标记的RNA探针M1和M2(图5a)。RNA pulldown显示,内源性IGF2BP3不与M2探针结合,而是优先与M1探针结合(图5b)。为了弄清楚CAUU基序是否有助于IGF2BP3的关联,作者通过将“CAUU”双核苷酸替换为“GUUU”,生成了一个M1突变体(M1-mut)RNA探针(图5a)。结果显示,M1-mut显著消除了IGF2BP3与circITGB6之间的相互作用(图5b),从而支持了该“CAUU”基序在介导circITGB6-IGF2BP3关联中的关键作用。
接下来,为了确认IGF2BP3与M1序列的直接相互作用,作者将重组的IGF2BP3蛋白与上述RNA探针孵育。pulldown和EMSA结果均证明IGF2BP3和M1之间的直接相互作用(图5c-d)。综上数据表明,IGF2BP3通过其CAUU基序与circITGB6结合。作者又通过体外转录和环化,生成生物素标记的circITGB6或其GUUU突变体circITGB6-mut,然后与重组IGF2BP3蛋白孵育。与预期的一样,circITGB6-mut几乎没有捕获IGF2BP3,而circITGB6-WT与IGF2BP3表现出很强的相互作用(图5f)。此外,作者还验证了IGF2BP3不和circITGB6-mut互作(图5g-h)。最终判定为,circITGB6通过“CAUU”区域直接与IGF2BP3相互作用。并且在细胞和小鼠模型中加以验证,circITGB6-mut表达并不能促进EMT过程。综上,进一步支持了circITGB6和IGF2BP3互作促进肿瘤转移。
 图5 circITGB6序列中IGF2BP3结合位点的鉴定
图5 circITGB6序列中IGF2BP3结合位点的鉴定
circITGB6通过与IGF2BP3的相互作用调节PDPN mRNA的稳定性
IGF2BP3通过调节RNA代谢、mRNA翻译和细胞内定位发挥生物学作用。考虑到circITGB6通过与IGF2BP3互作促进EMT过程和癌细胞迁移。那circITGB6是否通过调节IGF2BP3的某些mRNA载体来促进肿瘤转移的呢?
IGF2BP3可以与转移相关的转录本结合,如CD164、CD44s、MMP9和PDPN mRNA。结果显示,circITGB6过表达,显著提高MMP9和PDPN基因的mRNA水平,其中PDPN的基因和蛋白水平增加最为显著(图6a)。并且circITGB6敲低能够逆转过表达对于PDPN的影响。因此,在接下来的实验中重点关注了PDPN基因。
已有研究表明,口腔鳞状细胞癌细胞中IGF2BP3与PDPN的表达呈正相关,提示PDPN mRNA可能是IGF2BP3的下游RNA载体之一。实验结果表示,circITGB6和IGF2BP3对A549细胞中PDPN pre-mRNA的表达影响不大,表明circITGB6/IGF2BP3调节PDPN的表达而不依赖于其转录。鉴于IGF2BP3可以稳定其mRNA载体,作者推测circITGB6通过与IGF2BP3的相互作用来增加PDPN mRNA水平[2]。为了验证这一点,作者首先测量了强制表达不同circITGB6变体后的PDPN mRNA的半衰期。与预期的一样,circITGB6-WT可以明显延长PDPN mRNA的稳定性,并且增加IGF2BP3免疫沉淀部分中PDPN mRNA的富集,而不是circITGB6-MUT(图6d-e)。这些结果表明,circITGB6通过促进IGF2BP3与PDPN mRNA的相互作用来增强PDPN mRNA的稳定性。
考虑到IGF2BP3通过不同的RNA结合KH结构域与其它RNA结合,作者构建了具有单个KH结构域的IGF2BP3截断突变体,分析IGF2BP3如何与circITGB6和PDPN mRNA相互作用(图6f)。使用针对circITGB6或PDPN mRNA的探针进行pulldown分析显示,IGF2BP3的KH1结构域特异性结合circITGB6,而KH4结构域特异性结合PDPN mRNA(图6f),这一结果排除circITGB6与PDPN mRNA竞争结合IGF2BP3的相同KH结构域。
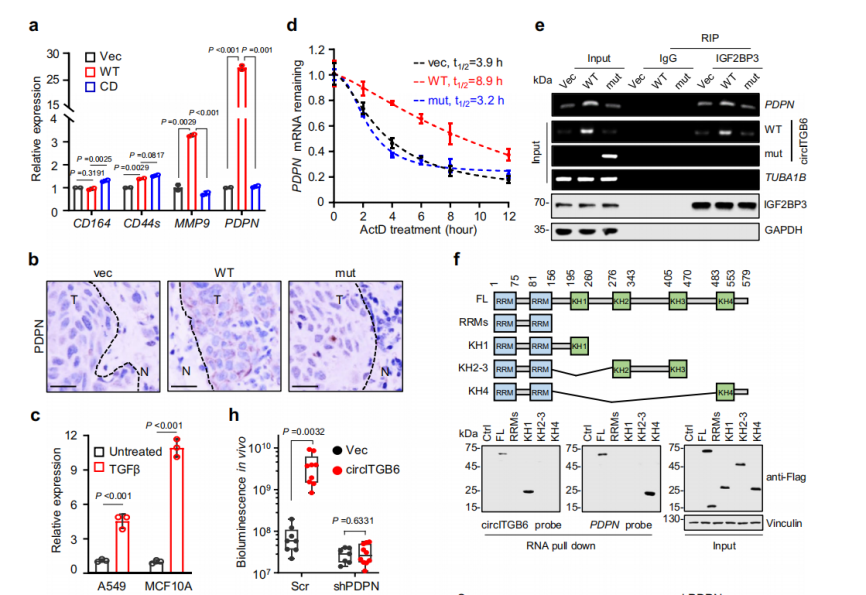 图6 circITGB6通过与IGF2BP3的相互作用调节PDPN mRNA的稳定性
图6 circITGB6通过与IGF2BP3的相互作用调节PDPN mRNA的稳定性
circITGB6通过PDPN通路诱导EMT过程和肿瘤转移
为了探究circITGB6的功能是否依赖于PDPN通路,作者通过敲低circITGB6过表达细胞中的PDPN来进行挽救实验。实验结果显示,敲低PDPN抑制了circITGB6介导的EMT过程和细胞迁移的变化。同样,小鼠体内实验也表明,敲低PDPN逆转了过表达circITGB6导致肺转移性结节的增加(图7g-i)。因此可以判定,circITGB6通过增强PDPN mRNA的稳定性来促进肿瘤转移。敲低IGF2BP3显著阻断了TGFβ刺激下PDPN的上调、细胞迁移能力、形态转变和EMT标志物的变化。综上所述,circITGB6/ IGFBP3/PDPN通路可正向调控TGFβ触发的EMT过程和细胞迁移。
脑转移在实体肿瘤中很常见,肺癌发生脑转移的倾向最高。因此,为了研究circITGB6/PDPN通路在脑转移中的意义,作者进行了三轮体内训练,以获得高脑转移性肺癌细胞(BrM)。Transwell迁移实验显示,与其亲本细胞相比,BrMs表现出更高的细胞迁移能力。重要的是,circITGB6和PDPN在BrMs中的表达均远高于亲本细胞。此外,在BrM细胞中也观察到PDPN mRNA的稳定性增强,提示circITGB6/PDPN通路参与了肺癌的脑转移。
为了进一步证实circITGB6/PDPN通路在肿瘤转移中的意义。与原发肿瘤相比,circITGB6和PDPN在转移性肿瘤中表达均增加,同时TGFβ丰度增加,e-钙粘蛋白减少和n-钙粘蛋白增加(图7j)。综上所述,TGFβ/circITGB6/PDPN通路在肿瘤转移中被激活。
 图7 circITGB6通过PDPN通路诱导EMT过程和肿瘤转移
图7 circITGB6通过PDPN通路诱导EMT过程和肿瘤转移
敲低circITGB6可有效抑制肿瘤转移
与没有癌症转移的样本相比,circITGB6和PDPN mRNA在有淋巴结转移的样本中表达更高(图8a)。并且在CRC患者中观察到circITGB6和PDPN mRNA水平之间存在正相关(图8b)。在118个肺癌样本中也进一步证实了这一结果(图8c-d)。因此,在CRC小鼠肝转移模型和人类癌症活检中,circITGB6的表达与PDPN的丰度呈正相关。
考虑到circITGB6在肿瘤转移中的关键作用及其与癌症进展的相关性,那circITGB6是否可能成为转移前肿瘤的潜在治疗靶点呢?为此,作者设计了circITGB6的siRNA,并验证了其只针对circITGB6敲低,而非ITGB6转录本(图8e)。结果发现,circITGB6 siRNA处理有效降低PDPN在mRNA和蛋白水平上的表达,并重新塑造了EMT标记物的表达,并抑制了细胞迁移;并且,敲低circITGB6后,PDPN mRNA的半衰期变短(图7f-h)。综上,敲低circITGB6可有效抑制肿瘤转移。
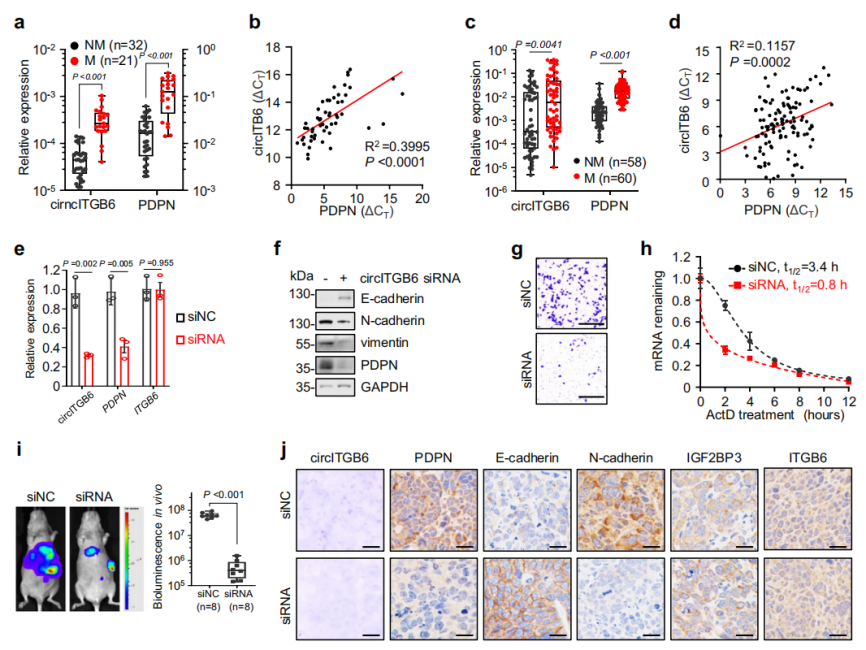 图8 敲低circITGB6可有效抑制肿瘤转移
图8 敲低circITGB6可有效抑制肿瘤转移
小结
环状RNA在肿瘤转移中的作用已有很多报道。本研究也详细地解析了circITGB6发挥肿瘤细胞转移功能的机制。circITGB6可被TGFβ诱导表达,促进了结直肠癌和肺癌的EMT过程和肿瘤转移过程。在机制上,circITGB6通过与IGF2BP3的直接互作,激活IGF2BP3并稳定其下游转录本PDPN mRNA的表达,促进肿瘤转移。不过,circITGB6的siRNA对肿瘤转移的抑制效果令人满意。这一重大发现,将为采用靶向circITGB6治疗癌症转移的方案提供有力依据。
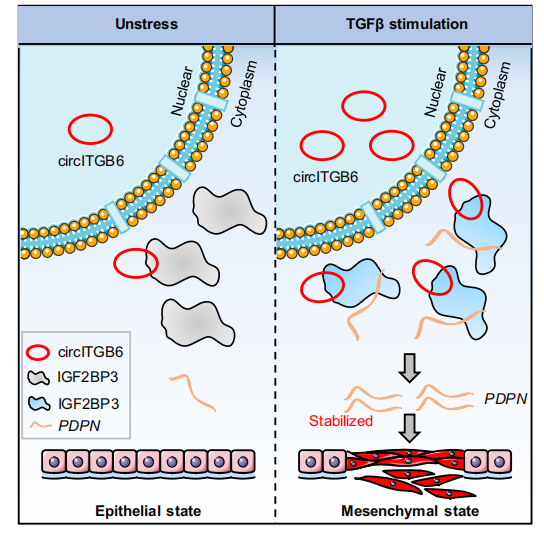 图9 摘要图
图9 摘要图
原文链接:
https://doi.org/10.1038/s41467-023-42571-1
参考文献:
1. Conn, S. J. et al. The RNA binding protein quaking regulates formation of circRNAs. Cell 160, 1125–1134 (2015).
2. Bell, J. L. et al. Insulin-like growth factor 2 mRNA-binding proteins (IGF2BPs): post-transcriptional drivers of cancer progression? Cell Mol. Life. Sci. 70, 2657–2675 (2013).
.png)